氟是自然界的微量元素之一,氟在自然界中以螢石(CaF2)、冰晶石、氟磷灰石等形式存在,這些礦物埋藏在地下,隨著地下水的侵蝕與沉積,F−被溶出并富集至地下水中,使得水中的F−濃度偏高。我國高氟水分布十分廣泛,尤其集中在北方地區,比如遼寧省中部,山東省西南部,圍繞渤海地區以及廣袤的西北地區都有大面積的高氟地下水區域,這些含氟地下水不僅給當地居民的飲水帶來諸多不便,而且會給當地的基礎建設和經濟發展帶來阻礙,根據資料顯示:氟與人體的身體健康密切相關,人體每天需要攝取的氟含量大約為0.1mg,大約90%攝入的氟會隨身體新陳代謝排除體外,留下的大部分氟會存在于身體的骨骼和牙齒之中,人體攝入氟的最主要途徑是飲食,這也是地方性氟中毒的主要原因,因此需要確保飲用水氟安全,過量攝入氟化物會導致人體骨骼、牙齒、肝臟、腎臟、大腦等的多器官毒性,目前仍缺乏有效的治療手段,除氟技術可以有效解決飲用水中氟含量超標的問題。
目前國內主要的除氟方法有吸附法、混凝沉淀法、離子交換法、反滲透等,吸附法由于其方法便捷、經濟高效等原因是目前飲用水除氟的主要方式。目前主要的吸附劑有鋁基金屬材料、天然礦石材料等,SANINI等利用CeO2改性活性氧化鋁來去除水中氟離子;AYALEW等比較了高嶺土和石灰石吸附劑對地下水中的除氟效果;LAONAPAKUL等通過煅燒高嶺土/羥基磷灰石復合材料來吸附除氟;THIRUNAVUKKARASU等對生物吸附做了系統性探討,闡述了生物吸附未來前景和發展潛力;AMIN等利用白腐菌杏鮑菇來吸附水溶液中的氟;韓曉峰等采用浸漬法制備了負載鑭鎂的活性氧化鋁吸附劑,該吸附劑在3h內可將10mg·L−1的含氟溶液中的氟離子去除95%左右;BAKHTA等利用通過金屬浸漬改性活性炭可提高其吸附性能,是一種很有前途的水處理材料。目前研究報道的大多數吸附劑存在以下缺點:1)吸附量不足,吸附效率不能滿足人們的需求。2)抗干擾離子能力弱,選擇性差。3)pH適宜范圍窄,尤其是生物吸附劑,水相pH對吸附劑吸附性能有很大影響,一般pH越低,除氟性能越好4)材料獲取困難,制作過程復雜。5)鋁基金屬吸附材料會有Al3+溶出的問題,不僅會造成2次污染,而且長期飲用含高鋁離子的水會給人體帶來危害。因此選擇一種高效、安全的飲用水除氟劑是吸附法的關鍵。
MgO作為我國儲量很大的金屬氧化物,具有高吸附能力、強親和力、熱穩定性,是一種十分安全并具有發展潛力的吸附除氟材料。劉理華等研究了棒狀改性氧化鎂及其吸附性能,發現經過改性后的氧化鎂有良好的吸附活性;王慧玲等利用酸改性活性氧化鎂,改性后吸附容量有所提高。本實驗為了提高活性氧化鎂的吸附容量和吸附效率,擴充活性氧化鎂適宜pH的范圍,增強活性氧化鎂與其他離子共存時的吸附能力,提高其選擇性和除氟穩定性,以活性氧化鎂作為多孔性載體,通過鐵鹽,鈣鹽浸漬使其附著在多孔性載體上或者內表面,再通過焙燒制得改性吸附劑,探討其最佳制備條件,并通過掃描電鏡,X射線粉末衍射儀,傅里葉變換紅外光譜儀對吸附劑進行表征。
1、材料與方法
1.1 材料與儀器
氧化鎂,檸檬酸三鈉,冰乙酸,氯化鈉,氯化鐵,氯化鈣,氫氧化鈉,氟化鈉,碳酸鈉,硝酸鈉,硫酸鈉,磷酸鈉,鹽酸均為分析純。
CJJ78-1磁力攪拌器;PF-2-01氟離子選擇電極;232參比電極;Multi3620pH計;PX223ZH/E電子分析天平;DHG-9013A恒溫鼓風干燥箱;SX2-2.5-10箱式高溫電阻爐;HWS-26恒溫水浴鍋;D8advanceX射線粉末衍射儀;MERLINcompact掃描電子顯微鏡;is5傅里葉變換紅外光譜儀。
1.2 實驗方法
將氧化鎂在420℃下灼燒1.5h得到活性氧化鎂,將活性氧化鎂與金屬鹽浸漬液按照1g:20mL的比例混合,并置于磁力攪拌器上攪拌2h,靜置,待出現明顯固液分離,用吸管將上清液吸出,將剩余含水的粘稠物質放入烘箱在105℃下烘干12h,將干燥固體取出研磨成粉末,放入馬弗爐內,在一定溫度下高溫焙燒2h,制得改性活性氧化鎂吸附劑。
對單一含氟水和模擬含氟飲用水用改性活性氧化鎂吸附除氟,用鹽酸和氫氧化鈉溶液調節pH,單一含氟水中只含有氟離子,模擬含氟飲用水中雜質離子有Cl−、CO32−、SO42−、NO3−、HPO42−、Na+。在實驗過程中,改變吸附時間、吸附劑投加量、pH等實驗因素以進行不同條件下的吸附實驗對比,吸附后,使用電極法測試濾液的氟離子濃度,計算除氟率和氟吸附量,每組實驗重復3次,取平均值作為最終結果。
2、結果與討論
2.1 樣品的SEM表征
活性氧化鎂、FeCl3-MgO、Fe2(SO4)3-MgO、CaCl2-MgOSEM表征結果如圖1所示,活性氧化鎂在電鏡下結構松散,顆粒之間空隙較大,改性吸附劑表面變得粗糙,表面有凸起的顆粒,比表面積變得更大。BET比表面積測試結果表明,活性氧化鎂、FeCl3-MgO、CaCl2-MgO的比表面積分別為17.724、47.423、56.642m2·g−1,改性后的吸附劑比表面積均提升了2倍以上,特別是經過Fe2(SO4)3改性后的吸附劑,由于活性氧化鎂在與水改性過程中生成了具有層狀結構的氫氧化鎂,而通過Fe2(SO4)3改性過程中并沒有破壞這一結構,而是在此結構上完成了負載,再經過高溫焙燒后失去水時的層狀結構被破壞轉為交錯的玫瑰狀,使得比表面積進一步增大,比表面積由改性前的17.724m2·g−1提高至62.492m2·g−1。負載在氧化鎂表面的鐵鹽和鈣鹽增加了吸附劑整體的正電性,F−本身帶有負電,彼此之間的吸引有利于F−游離至改性吸附劑附近,改性吸附劑更大、更粗糙的比表面積有利于更多的與F−接觸,使得吸附初期F−與吸附劑表面接觸更加頻繁,同時Fe與F−直接的絡合反應加快了反應速率。

2.2 樣品的XRD表征
活性氧化鎂、FeCl3-MgO、Fe2(SO4)3-MgO、CaCl2-MgO的XRD表征結果如圖2所示。由圖2(b)可以看出,在衍射角為37.00、42.95、62.35、74.75、78.65°處出現MgO衍射峰,說明MgO仍然是改性吸附劑的主體成分。在FeCl3-MgO的圖譜中出現了少量的Mg(OH)2(在18.60、38.05、50.83、58.50、68.50°附近的衍射峰),但改性前后各組分峰形和峰位置并未發生明顯的變化。說明改性過程并沒有改變活性氧化鎂的晶格結構。在圖2(b)中未出現鐵的吸收峰,說明鐵可能以無定型的物質形式附著在氧化鎂表面。
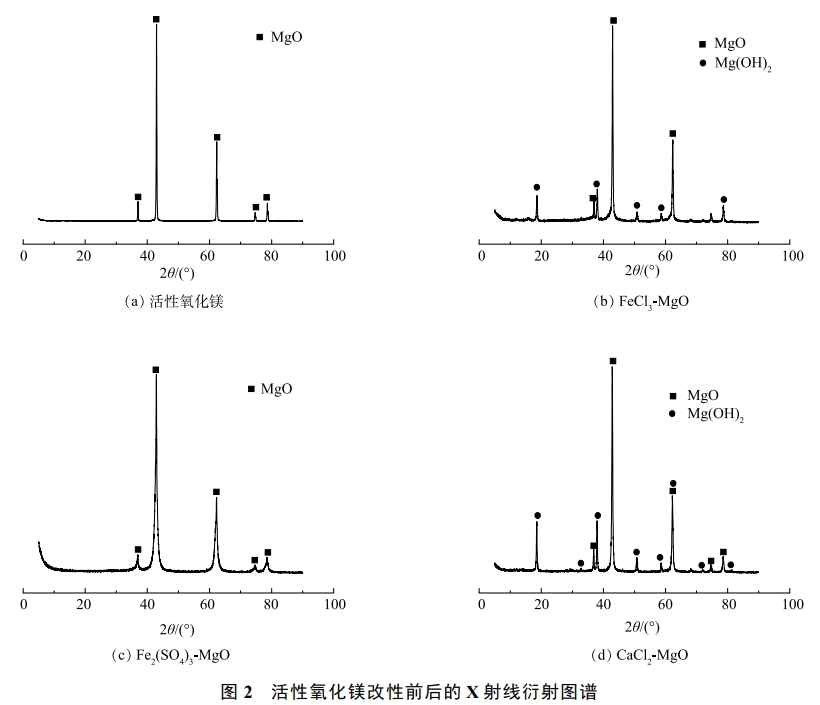
Fe2(SO4)3-MgO的XRD圖譜中只有氧化鎂出現并沒有出現Mg(OH)2,原因是在最佳焙燒溫度(500℃)下Mg(OH)2重新分解為氧化鎂,可見鐵鹽的改性并沒有改變活性氧化鎂的物質結構,鐵鹽并沒有出現穩定的物質結構,可能是以無定型金屬化合物的形式附著在活性氧化鎂表面。
CaCl2-MgO的XRD圖譜和FeCl3-MgO的XRD圖譜類似,圖中的衍射峰依舊是以MgO為主體,強度較低的峰位置出現少量的Mg(OH)2。這是因為在400℃的焙燒溫度下,鈣鹽的改性對于氧化鎂晶體結構影響較小,鈣類物質并沒有出現穩定的物質結晶,可能是其以無定型的形式附著在氧化鎂表面。
2.3 樣品的FTIR表征
活性氧化鎂、FeCl3-MgO、Fe2(SO4)3-MgO、CaCl2-MgOFTIR紅外光譜如圖3所示。改性對于活性氧化鎂表面官能團或者化學鍵有一定影響。可見,吸附前的活性氧化鎂在1439、1633、3434cm−1出現的吸收峰歸屬為CO32−非對稱伸縮振動、吸附水O—H的彎曲振動和伸縮振動。FeCl3-MgO在1409、1437、3404cm−1處出現的吸收峰指示的官能團或共價鍵與活性氧化鎂一致,在3628cm−1和3697cm−1處出現的吸收峰歸屬為O—H的伸縮振動。Fe2(SO4)3-MgO在1477、1634、3436cm−1處出現的吸收峰對應的官能團與活性氧化鎂一致,1089cm−1處出現SO42−中的S=O振動的吸收峰,其形成可能來自于高價位S與Fe,Mg氧化物的雙配位吸附。CaCl2-MgO在1448、1638、3427、3696cm−1處出現的吸收峰指示與活性氧化鎂一致,在2939cm−1處出現的吸收峰與鈣,水汽和二氧化碳生成的化合物有關,可見CaCl2-MgO對二氧化碳等物質的吸收高于活性氧化鎂。
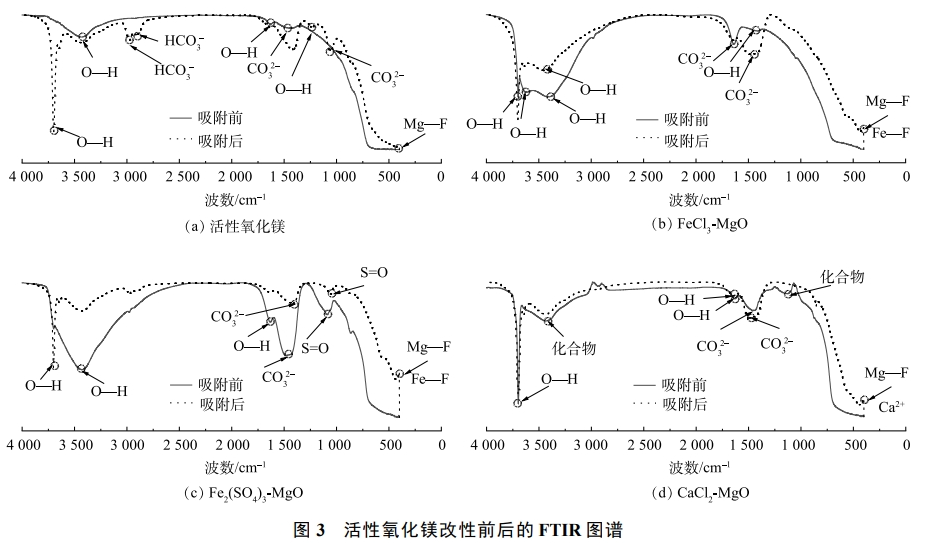
由圖3可以看出,吸附后的FeCl3-MgO在426cm−1處出現新的吸收峰,其歸屬為Mg—F鍵和Fe—F鍵的出現,CO32−的非對稱伸縮振動吸收峰和吸附水O—H的伸縮振動吸收峰均出現藍移,說明FeCl3-MgO表面吸收水和CO32−結合更穩定。Fe2(SO4)3-MgO吸附后在439cm−1和3700cm−1處出現新的吸收峰,分別歸屬為Mg—F鍵,Fe—F鍵和結構水O-H的伸縮振動,指示為SO42−中S=O振動的吸收峰和CO32−非對稱伸縮振動的吸收峰均出現紅移,說明Fe2(SO4)3-MgO表面的SO42−和CO32−結合更不穩定。CaCl2-MgO在443cm−1處出現吸收峰,歸屬為Mg—F鍵和Ca2+的移動。吸收水O—H的彎曲振動峰和CO32−非對稱伸縮振動峰均出現藍移,說明CaCl2-MgO表面吸收水和CO32−的結合穩定性增強。活性氧化鎂、FeCl3-MgO、Fe2(SO4)3-MgO、CaCl2-MgO在含氟廢水中水解后,吸附劑表面附著大量O—H,因此活性氧化鎂基吸附劑F−與吸附劑表面的羥基的離子互換為除氟的主要過程,Mg-F鍵的出現是因為水中F−離子與O—H發生離子交換吸附于吸附劑表面,其過程如式(1)所示。
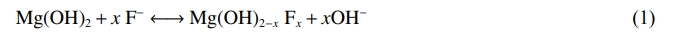
同時MgO也可與F−發生選擇性吸附,其可由共價鍵和絡合反應實現,而水中的MgOH+和MgF+又可通過靜電吸引進一步吸附F−,Fe—F鍵的生成說明改性活性氧化鎂表面的無定型鐵水解后生成Fe(OH)3,之后主要通過絡合反應(配位反應)實現Fe與F的結合,同時釋放OH−,絡合反應吸附能量比離子反應更強,對F−的選擇性更高。鈣鹽改性后的氧化鎂雖然沒有Ca—F鍵的出現,但鈣鹽是以無定型的形式附著在MgO表面,Ca2+本身可以與F−發生反應生成CaF2沉淀,CaF2比CaCO3,Ca(HCO3)2等其他陰離子結合的鹽類更穩定,因此,F−會優先與Ca2+結合,使得鈣鹽改性后的吸附劑對氟離子選擇性吸附增強,抵抗其他陰離子干擾的能力增強,并且鐵鹽和鈣鹽對氟離子的親和力很高,氟離子被吸附后不易被替換。
2.4 Zeta電位分析
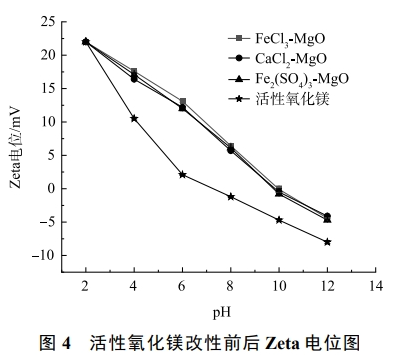
在pH分別為2、4、6、8、10、12的條件下,活性氧化鎂、FeCl3-MgO、Fe2(SO4)3-MgO、CaCl2-MgO的Zeta電位測試結果如圖4所示。可見,隨著pH的升高,3種改性吸附劑的Zeta電位在不斷下降,由最初的22mV降至−4.2mV左右。這是因為在pH較低時溶液中含有較多的H+,H+與改性吸附劑結合,使得吸附劑表面電負性降低;當pH升高時,溶液中含有較多的OH−,OH−與改性吸附劑結合,使得表面電負性增加。3種改性吸附劑的零點電位在9.97左右,當pH<9.97時,改性吸附劑表面帶有正電,有利于吸附帶有負電的氟離子;當pH>9.97時,吸附劑表面帶有負電會排斥帶有負電的氟離子。改性后的吸附劑零電位點所對應的pH較高,在較寬的pH范圍內都有利于吸附氟離子,活性氧化鎂由于零點電位較低,吸附氟離子的有利pH范圍較窄。
2.5 浸漬液濃度對除氟率的影響
在溫度為25℃,浸漬液中金屬鹽離子濃度分別為0.01、0.03、0.05、0.1、0.15mol·L−1,初始氟離子溶液質量濃度為20mg·L−1,吸附時間為12h,浸漬液中金屬鹽離子濃度對除氟率的影響如圖5所示。可見,FeCl3-MgO會隨著FeCl3浸漬液濃度增加除氟率先升高后降低。其原因是當FeCl3濃度較低時,浸漬改性會生成更多的氟離子吸附位點,當FeCl3濃度逐漸升高時,FeCl3會堵塞活性氧化鎂表面的空隙,使得吸附位點與氟離子接觸變少,導致除氟率下降,因此,FeCl3最佳浸漬濃度為0.05mol·L−1。
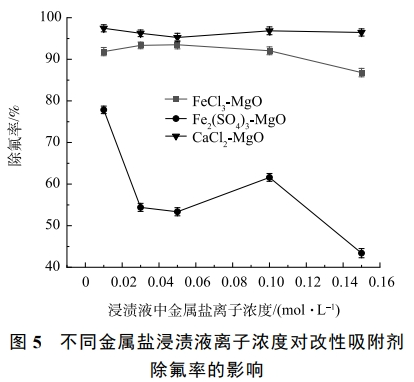
隨著CaCl2浸漬液離子濃度增加,CaCl2-MgO的除氟效果略微提升。這是因為少量CaCl2會提供更多的氟離子吸附位點,隨著濃度的提高,過多的CaCl2會導致氧化鎂表面吸附孔隙被堵塞,氟離子與活性氧化鎂表面的吸附位點接觸概率變低,導致除氟率下降。因此,CaCl2-MgO的最佳CaCl2浸漬液離子濃度為0.01mol·L−1。
Fe2(SO4)3-MgO受Fe2(SO4)3浸漬液離子濃度變化影響較大。當Fe2(SO4)3浸漬液離子濃度濃度由0.01mol·L−1升到0.03mol·L−1時,Fe2(SO4)3-MgO的除氟率由80%迅速降至50%左右;當Fe2(SO4)3由0.05mol·L−1增加到0.10mol·L−1時,除氟率有一定上升,但除氟率仍低于Fe2(SO4)3為0.01mol·L−1時制得的Fe2(SO4)3-MgO。這是因為Fe2(SO4)3有著較大的分子質量,當Fe2(SO4)3以無定型結構附著在氧化鎂表面時,更容易堵塞氧化鎂表面的吸附位點,使得氟離子難以被吸附,導致除氟率顯著下降。因此,確定0.01mol·L−1為Fe2(SO4)3-MgO的最佳浸漬液離子濃度。
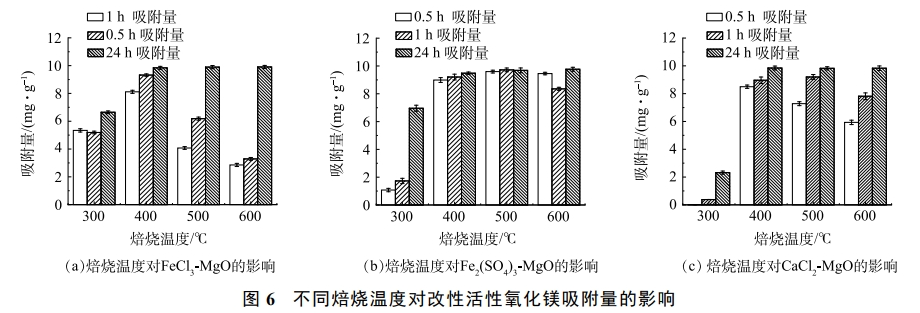
2.6 焙燒溫度對吸附效果的影響
在溫度為25℃,初始氟離子質量濃度為20mg·L−1,調節溶液pH至7,焙燒溫度對吸附劑除氟效果的影響如圖6所示。可見,隨著焙燒溫度增加,吸附容量隨之增加,當達到一定溫度后,吸附劑的吸附量基本維持不變,400℃為FeCl3-MgO和CaCl2-MgO的最適焙燒溫度,500℃為Fe2(SO4)3-MgO的最適焙燒溫度。當焙燒溫度過低時,吸附量較低,原因是吸附劑內結構水散失過少,不利于吸附位點的生成;焙燒溫度過高,也會略微影響吸附量,原因是溫度過高顆粒的過度結晶和團聚使吸附劑表面作用降低,吸附性能下降。焙燒使得鐵鹽和鈣鹽以無定型形態負載在活性氧化鎂表面,當達到一定溫度時,活性氧化鎂表面負載量達到飽和,吸附劑的吸附量便基本維持不變。
2.7 吸附劑投加量對于吸附效果的影響
在溫度為25℃時,分別向實驗水樣中投加不同劑量的活性氧化鎂、FeCl3-MgO、Fe2(SO4)3-MgO、CaCl2-MgO,初始氟離子溶液質量濃度為20mg·L−1,吸附時間12h,吸附劑投加量對于吸附效果的影響如圖7所示。4種吸附劑的除氟率均隨其投加量的增加先快速升高然后趨于穩定,最終達到吸附平衡。由圖7(a)、圖7(b)、圖7(d)可見,活性氧化鎂、FeCl3-MgO、CaCl2-MgO3種吸附劑在投加量為2g·L−1時除氟率均達到最大,吸附劑投加量繼續增加,除氟率基本維持不變。由圖7(c)可見,Fe2(SO4)3-MgO除氟率隨著投加量的增加快速升高,但除氟率始終略低于活性氧化鎂、FeCl3-MgO、CaCl2-MgO,當吸附劑用量達到4.5g·L−1左右,除氟率趨于穩定并與活性氧化鎂,FeCl3-MgO和CaCl2-MgO的除氟率相當,繼續增加吸附劑的投加量,除氟率基本保持不變,達到吸附平衡。
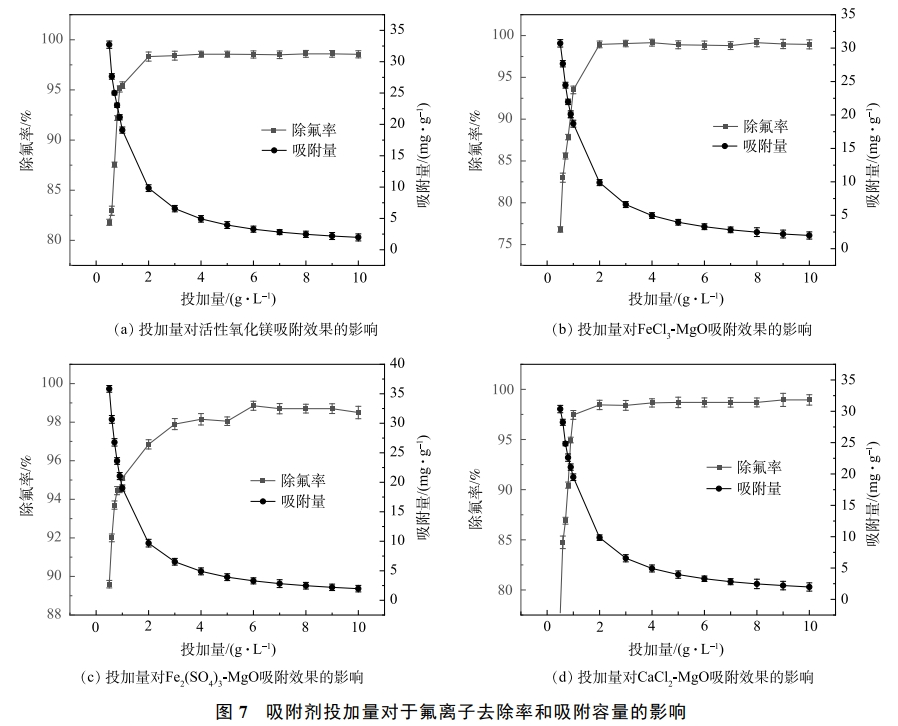
由圖7可見,在吸附劑用量未達到3g·L−1時,隨著吸附劑用量的增加,4種吸附劑的吸附容量均會快速降低,當吸附劑投加量大于3g·L−1,吸附容量會緩慢下降。這是因為剛開始投加吸附劑的時候,吸附氟離子的活性位點較多,隨著投加量的增加,吸附位點逐漸被占據,利用率下降,當吸附劑用量達到3g·L−1左右時,基本達到吸附平衡,這時吸附劑會緩慢吸收溶液中的氟離子,吸附位點基本被占據,吸附容量會緩慢下降。
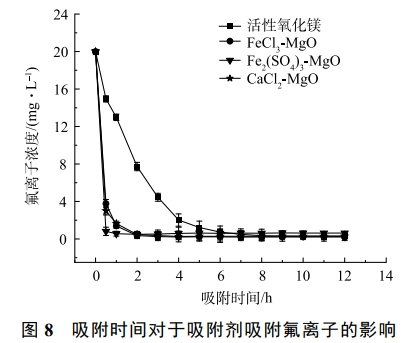
2.8 吸附時間對于吸附效果的影響
在溫度為25℃,改性吸附劑投加量為2g·L−1,初始氟離子溶液質量濃度為20mg·L−1,吸附時間對于吸附效果的影響如圖8所示。在吸附初期,4種吸附劑吸附速率均較快,隨后,吸附速率減慢,直至達到吸附平衡,活性氧化鎂吸附氟離子速率較慢,7h達到吸附平衡,除氟效率低,CaCl2-MgO、FeCl3-MgO、Fe2(SO4)3-MgO除氟速率快,在2h左右達到吸附平衡,除氟率均可達95%以上。
2.9 pH對于吸附劑吸附效果的影響
含氟溶液的pH會引起吸附劑表面電位的變化,影響吸附劑的吸附性能。在溫度為25℃,改性吸附劑投加量為2g·L−1,初始氟離子溶液質量濃度為20mg·L−1,吸附時間為12h,探究pH對去除率的影響。如圖9所示,pH<7時活性氧化鎂可以達到90%左右的去除率,當pH>7時活性氧化鎂除氟率有明顯的下降,pH>10時,活性氧化鎂除氟率進一步下降。由此得出pH對于活性氧化鎂除氟性能有很大的影響,活性氧化鎂在酸性或者中性的環境下能有較好的除氟效果。隨著pH升高,溶液中存在較多的OH−,OH−易于和金屬吸附劑表面結合,使得活性氧化鎂表面帶負電,不利于吸附同為陰離子的氟離子。
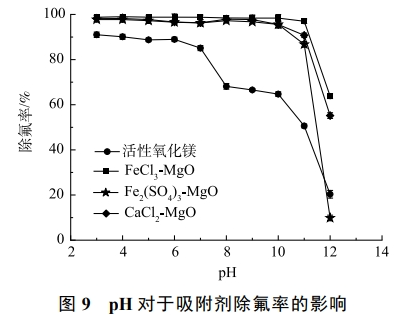
改性后的3種吸附劑在pH>11后除氟率均有顯著下降。這是因為改性后的吸附劑表面酸性位點增加,當pH升高時,溶液中的OH−會與吸附劑表面的酸性位點結合,從而提高吸附劑pH的緩沖能力,但吸附位點數量有限,OH−與吸附位點結合后使得F−不能與吸附位點結合,導致除氟率降低。由Zeta電位變化可以得出,改性后的吸附劑由于零電位點所對應pH較高,因此,在較寬的pH范圍內均有良好的除氟效果。此外,有研究表明,SO42−與F−的交換可以在堿性條件下順利進行,這也是經過Fe2(SO4)3改性后的活性氧化鎂適宜pH擴大的原因之一。在pH<11的環境下,CaCl2-MgO、FeCl3-MgO、Fe2(SO4)3-MgO均能保持90%以上的去除率,改性后的吸附劑適應水溶液酸堿環境的能力顯著增強。
2.10 模擬實際水樣的除氟效果
天然的含氟水是一個復雜的水體環境,在進行除氟處理時,要考慮水體中其他離子對除氟的影響。為此,在25℃,吸附劑投加量為2g·L−1,初始氟離子質量濃度為5mg·L−1,吸附時間12h,共存離子(Cl−、SO42−、CO32−、NO3−、HPO42−、Na+)的質量濃度為5mg·L−1的條件下,考察吸附劑在復雜水體環境中的除氟效果,結果如圖10所示。
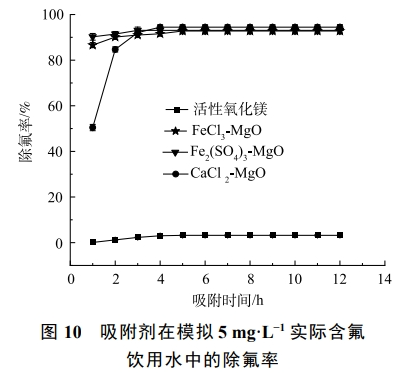
活性氧化鎂在實際含氟飲用水環境中達到吸附平衡后對氟離子的去除率不足10%,除氟效果差,CaCl2-MgO、FeCl3-MgO和Fe2(SO4)3-MgO在實際含氟飲用水溶液中達到吸附平衡后依然保持了90%以上的氟離子去除率,剩余F−質量濃度均小于1mg·L−1,滿足國家飲用水含氟標準,可見改性后的吸附劑對氟離子的選擇性顯著增強,在實際飲用水除氟中有良好的效果。
2.11 吸附等溫線
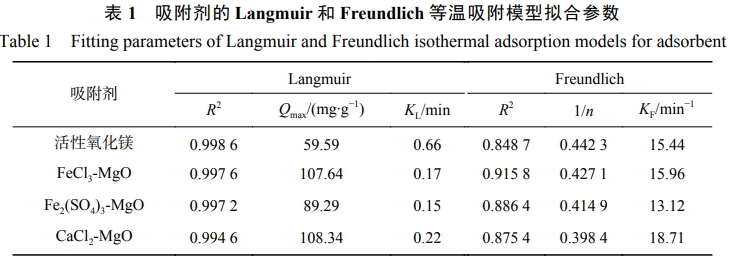
取0.1g活性氧化鎂、FeCl3-MgO、Fe2(SO4)3-MgO、CaCl2-MgO分別置于100mL初始氟離子溶液質量濃度為5、10、20、25、100、200、300mg·L−1的模擬含氟水中,在室溫25℃下測量吸附12h后的氟離子質量濃度,分別對其進行Langmuir(式(2))和Freundlich(式(3))等溫吸附模型擬合,擬合結果如表1所示。

式中:Ce為吸附后溶液的平衡質量濃度,mg∙L−1;Qe為平衡吸附量,mg∙g−1;Qmax為最大吸附量,mg∙g−1;KL為Langmuir平衡常數,L∙mg−1;KF為Freundlich平衡常數,L∙mg−1
4種吸附劑的Langmuir吸附等溫模型擬合相關性系數R2均大于Freundlich吸附等溫模型擬合相關性系數,說明活性氧化鎂、FeCl3-MgO、Fe2(SO4)3-MgO、CaCl2-MgO,對F−的吸附更傾向于單分子層吸附,FeCl3-MgO、Fe2(SO4)3-MgO、CaCl2-MgO的最大吸附容量均有顯著增加,經過氯化鐵改性后的吸附劑吸附容量大于經過硫酸鐵改性的吸附容量,原因是經過硫酸鐵改性后的吸附劑吸附達到短暫平衡后又有F−溶出。
在Freundlich吸附等溫模型中,1/n可反映吸附的有利程度,0<1/n<1有利于吸附的發生。由表1可以看出,4種改性吸附劑1/n均為0<1/n<1,說明4種吸附劑均有較好的吸附強度,3種改性吸附劑的1/n均小于活性氧化鎂1/n,說明FeCl3、Fe2(SO4)3和CaCl2的改性有利于活性氧化鎂的吸附。
2.12 改性吸附劑的穩定性
取0.1gCaCl2-MgO于燒杯中,加入超純水100mL,于25℃下以150r·min−1振蕩120min,利用離心機將振蕩后的固液分離,采用鎂試劑測試水樣中的鎂離子含量,結果未檢出鎂離子,另外對CaCl2-MgO除氟后的水樣進行檢測,同樣未檢測出鎂離子;取0.1g鐵鹽改性吸附劑于燒杯中,在上述相同的條件下重復實驗未見有沉淀析出。表明Mg2+不會隨著反應滲入溶液中,不會造成二次污染。
取0.1g鐵鹽改性吸附劑于燒杯中,在上述相同的條件下取上清液加入少量氫氧化鈉溶液,未見有沉淀出現;取0.1gCaCl2-MgO于燒杯中,在上述相同的條件下取上清液加入少量碳酸鈉溶液,未見出現沉淀,表明浸漬鹽的離子并不會隨著反應滲到溶液中。這說明改性吸附劑穩定性良好,不會造成新的污染。
取0.1g改性吸附劑與燒杯中,加入超純水100mL,于25℃下以150r·min−1振蕩120min,采用鎂試劑測試水樣中的鎂離子含量,結果未檢出鎂離子。另外對改性吸附劑除氟后的水樣進行檢測,同樣未檢測出鎂離子,表明改性吸附劑穩定性好,除氟過程未有其他離子溶出,不會造成二次污染。
取0.1g鐵鹽改性吸附劑與燒杯中,在上述相同的操作條件下,未見有沉淀出現;取0.1gCaCl2-MgO于燒杯中,在同樣的操作條件下,未出現沉淀,表明浸漬鹽的離子并不會隨著反應滲到溶液中。這說明改性吸附劑穩定性良好,不會造成新的污染。
3、結論
1)改性后的氧化鎂內部結構更加緊密,比表面積顯著增加,與氟離子結合的活性位點增多,且活性位點更加穩定,從而提高了對氟離子的吸附效率,由鐵鹽和鈣鹽改性后的吸附劑仍以氧化鎂為主體,鈣鹽和鐵鹽是以無定型的形態附著在活性氧化鎂表面。
2)活性氧化鎂通過F−與OH−的離子交換去除廢水中的氟離子,鐵鹽改性的吸附劑由于Fe-F鍵的出現,吸附過程不僅有離子交換還有絡合反應,絡合反應的反應能量大于離子交換,絡合反應可加強吸附劑對氟離子的選擇性吸附;鈣鹽改性的吸附劑盡管沒有形成Ca-F鍵,但Ca2+可與F−反應直接生成CaF2沉淀,CaF2比其他陰離子與F−結合的穩定性高,經過鈣鹽,鐵鹽改性后的吸附劑抵抗共存陰離子干擾的能力大大增強
3)改性吸附劑吸附容量顯著增加,吸附速率顯著提高。適宜的浸漬濃度和適宜的焙燒溫度會增強改性吸附劑的除氟效果,FeCl3-MgO和CaCl2-MgO的最佳焙燒溫度是400℃,Fe2(SO4)3-MgO的最佳焙燒溫度是500℃。
4)改性后的吸附劑有較高的零電位點,適宜pH范圍變寬,pH在3~10內均可維持較高的除氟率。改性吸附劑符合Langmuir等溫模型,改性吸附劑除氟后水樣未有鎂離子和浸漬鹽離子溶出,不會造成2次污染。(來源:山東建筑大學市政與環境工程學院,山東建筑大學資源與環境研究院)



