目前,約 80%的世界能源供給依靠化石能源。在有機廢水處理的過程中,既可以去除污染物,又能夠回收生物氣的技術越來越受到青睞。廢水厭氧發酵處理過程具有去除污染物和回收生物氣的雙重作用,可回收利用的生物氣主要為甲烷和氫氣。pH 值是污水厭氧處理系統中最重要的參數之一,它會影響到系統微生物的活性、營養的攝取和產氣性能。厭氧發酵在實際運行過程中,常需要投加大量堿性物質以維持較高的堿度和適宜 pH 值(7. 0 左右) ,這會增加運行成本。有文獻報道一些耐酸產甲烷細菌(如Methanobacteriaceae、Methanomicrobiales 和 Methanosarcinaceae)能在 pH 為 4. 4 的條件下存活,TAC-ONI 等也曾報道由于產甲烷細菌對酸性條件的適應,當產甲烷系統 pH 從 7. 0 下降到 4. 5 時,與對照組相比,系統產甲烷活性增加了 30% 。如果能在較低的 pH 條件(如 pH 低于 4. 5)進行厭氧發酵以處理有機廢水,可減少堿性藥劑的投加量從而節約運行成本,也能拓寬厭氧處理工藝的應用領域。在厭氧發酵過程中,較高的有機負荷容易造成有機酸的大量積累,引起 pH 值大幅度下降,嚴重影響發酵性能,這一現象在厭氧發酵系統中被稱為“酸化”。
研究發現,厭氧發酵系統酸化會引起 pH 下降、產氣速率下降、COD 去除率降低,嚴重時會引起整個系統崩潰。在低 pH 值厭氧發酵系統也會出現酸化現象,而目前針對酸化的研究主要為中性 pH 厭氧發酵系統,對低 pH 厭氧發酵系統中酸化的研究對實際應用具有指導意義。
本文利用已經培養出顆粒污泥的厭氧內循環反應器( anaerobic internal circulation reactor,AICR) ,通過提高有機負荷使系統出現酸化,在此過程中研究了酸化前后反應器運行參數的變化以及酸化后的厭氧顆粒污泥中微生物的組成情況,旨在探明酸化對低 pH 值厭氧系統的危害,為實際厭氧污水處理系統提供借鑒。
1 實驗材料和方法
1. 1 實驗裝置
實驗裝置如圖 1 所示,采用自制的 AICR。 此反應器由有機玻璃制成,反應器外壁纏繞電熱絲和保溫層以加熱保溫,通過溫控儀將反應器內溫度控制在(37 ± 1)℃。
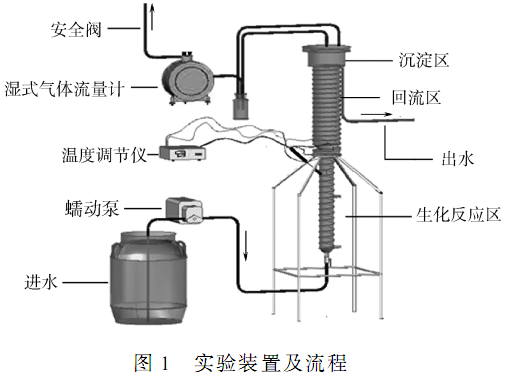
反應器下部為反應區、上部為污泥回流區和污泥沉淀區。 反應區和反應器頂部分別各設氣-液-固三相分離器。 反應器總容積為 10. 2 L(其中,反應區容積為 3 L,沉淀區容積為 2. 2 L,回流區容積為5 L) 。
廢水從反應器底部進入,首先進入下部反應區,反應區內有培養成熟的顆粒污泥床層。 廢水中 COD在此降解,同時產生生物氣。 氣、水和顆粒污泥在反應區頂部的三相分離器進行初次分離后,大部分顆粒污泥被截留在此區。 少部分被出水和氣體攜帶而出,隨混合液進入上部的污泥回流區,污泥回流區頂部還有一個三相分離器,進行氣、固、液的進一步分離。 顆粒污泥由沉淀區返回反應區,氣體經水封瓶和流量計后可回收利用。 處理后出水進入后續反應器。
1. 2 污泥接種與底物
接種污泥取自實驗室長期運行的厭氧反應器中的顆粒污泥。 接種體積、混合液懸浮固體(MLSS)濃度和混合液揮發性懸浮固體(MLVSS)濃度分別為 5L、65. 71 g·L - 1和 62. 81 g·L - 1。
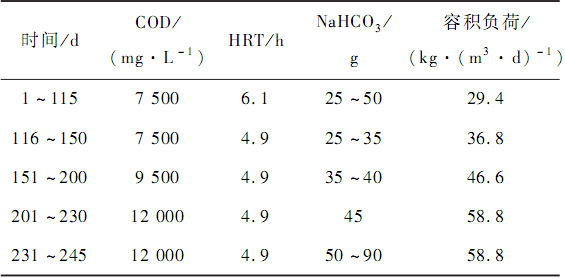
實驗進水為模擬制糖廢水,進水 COD 見表 1,加入適量的氮源(尿素)和磷源(磷酸二氫鉀)調節COD ∶ N ∶ P 的比例約為 700 ∶ 5 ∶ 1,按需投加 NaHCO3以調節系統 pH 值,加入適量微量元素液以滿足微生物正常生長代謝需求,微量元素溶液的組成為7. 38 mg·L - 1MnSO4 ,5 mg·L - 1NiCl2 ,0. 07 mg·L - 1(NH4 ) 6 Mo7O24 ,17 mg·L - 1K2 HPO4 ,13 mg·L - 1KI,4. 92 mg·L - 1FeSO4 ,40. 66 mg·L - 1MgCl,2. 1 mg·L - 1CoCl2 ,4. 88 mg·L - 1CuSO4 ,0. 84 mg·L - 1(CH3COO) 2 Zn。
表 1 反應器在不同時間的實驗參數
1. 3 實驗方案
培養出顆粒污泥的厭氧發酵系統,穩定運行 115 d 后,在其他條件不變的情況下,提高進水 COD 濃度。 容積負荷從 29. 4 kg·(m3·d) - 1逐步增加到 58. 8 kg·(m3·d) - 1。
在第 231 天,系統 pH 突然降低至 4. 0 以下,出水堿度低于 400 mg·L - 1,液相末端產物(揮發性有機酸和乙醇)與堿度的比值大于 10,即認為系統處于過酸化狀態,受到酸化沖擊。 酸化后,通過增加堿的投加量進行系統酸化后的恢復。為分析酸化后系統微生物種群結構,在酸化后(第 245 天)采集污泥樣進行高通量測序。
1. 4 分析方法
堿度( alkalinity) 、COD、MLSS 和 MLVSS 的測定參照標準方法,pH 和氧化還原電位(ORP)采用便攜式多參數測定儀( pH / Oxi 340i,德國,WTW)測定,反應產生氣體體積用濕式氣體流量計測量。
氣體體積分數由配有 TCD 檢測器的氣相色譜( GC2088ITF,成都,成都儀器廠)檢測,內裝 PorapaKQ柱。 熱導檢測器、汽化室溫度和柱溫分別為 100、70 和 50 ℃。 以氮氣作為載氣,載氣流量為 30 mL·min - 1。總產氣速率( total biogas production rate)計算:日產氣量(以物質的量計)除以反應器反應區體積。氫氣產率( hydrogen production rate)由總產氣速率乘氫氣體積分數得到。 甲烷產率( methane productionrate)由總產氣速率乘甲烷體積分數得到。
揮發性有機酸(VFAs)和乙醇由配有 FID 檢測器(GC5890,南京,南京科捷分析儀器有限公司)的測定,內裝 FFAP 毛細管柱。 氫氣作為燃氣,載氣為氮氣,其中氮氣流量為 30 mL·min - 1。 檢測器溫度、柱溫和汽化室溫度分別設置為 230、100 和 230 ℃。 采取程序升溫,初始溫度 100 ℃,停留時間 3 min,升溫速度20 ℃·min - 1,終止溫度 180 ℃,停留時間 3 min。
微生物群落結構采用高通量測序進行分析,污泥樣采集后儲存于 - 80 ℃冰箱以備 DNA 的提取。 測序方法中引物體系能有效擴增出 16S rDNA 的 3 個可變區(V3,V4,V5) ,能夠精確鑒定出包含古生菌在內的更多的物種分類。 測序樣本經檢驗合格后,經過 PCR 擴增、混樣、建庫及文庫 QC,最后檢測合格的文庫進行高通量測序,得到的測序數據會用于物種鑒定分析。 高通量測序詳細操作見 FU 等在文中描述。
2 實驗結果與討論
2. 1 酸化對系統 pH 和堿度的影響
如圖 2 所示,在酸化前的穩定階段,系統運行 pH 為 4. 2 ~ 4. 5,發酵氣體中甲烷和氫氣各占 15% 和12% ,進水 NaHCO3 日投加量為 45 g,進水堿度約為710 mg·L - 1,堿度消耗量穩定在(320 ± 40)mg·L - 1范圍內,出水堿度維持在 400 mg·L - 1以上。 當進水COD 濃度從 9 500 mg·L - 1提高至 12 000 mg·L - 1運行 30 d 后,系統 pH 降至 3. 94,出水堿度低于400 mg·L - 1,即系統受到酸化沖擊。
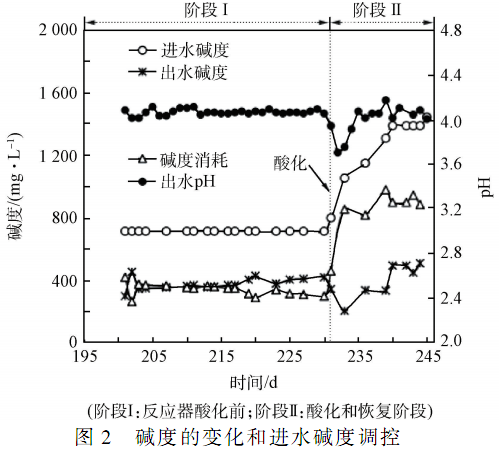
酸化后,為維持出水 pH 在 4. 2 ~ 4. 5 范圍內,在不改變其他運行參數的情況下,從 231 d 開始,NaHCO3 的日投加量從 45 g 升至 50 g,并逐漸增加,當升至 90 g 時(第 240 天) ,系統出水 pH 穩定在4. 2 ~ 4. 5 范圍內。 進水堿度隨 NaHCO3 的增加而增加,最終維持在 1 385 mg·L - 1左右才可保障出水的pH 維持在 4. 2 以上。 酸化后,堿度的消耗量逐漸增加,最終穩定在 900 mg·L - 1左右。 酸化導致系統堿度消耗量的增加的原因可能是:一方面,酸化使系統緩沖能力的穩定性遭到破壞,并且 pH 大幅度下降,酸化后需要外界長期提供較高的堿度以恢復系統的緩沖能力,并提高系統的 pH 值;另一方面,在酸化前,系統能同時產生氫氣和甲烷,產甲烷過程會為系統內部提供部分堿度,酸化后產甲烷活性受到抑制,酸化前產甲烷過程產生的部分堿度需由外界提供,所以堿度消耗量增加。 在酸化階段,出水堿度迅速下降,隨著進水堿度的增加,出水堿度逐漸恢復,最終穩定在 500 mg·L - 1左右。 在實際運行過程中,當系統堿度消耗量有明顯上升時,應立即增加進水中堿的投加量以提高進水堿度,從而避免系統受到酸化沖擊。
2. 2 酸化對系統 COD 去除和污泥形態的影響
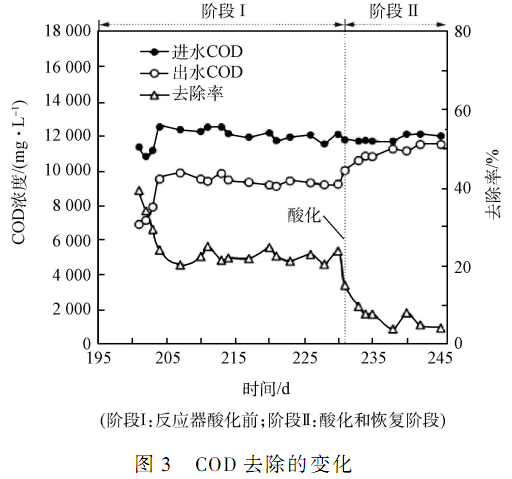
如圖 3 所示,進水 COD 濃度上升至 12 000 mg·L - 1時(從第 201 天開始) ,容積負荷也增加至 58. 8kg·(m3·d) - 1,出水 COD 逐漸升高至 9 000 mg·L - 1左右,COD 去除率也逐漸下降至20% ~ 25%的范圍內。 在第 231 天,系統發生酸化時,COD 去除率急劇下降,最終維持在 4%左右。 雖然后續采取了相應補救措施,可使出水 pH 恢復至 4. 0 以上,但 COD 去除率仍然很難恢復。
在酸化前,系統中污泥為乳白色顆粒污泥(圖 4( a) ) ;酸化后,污泥逐漸解體為絮狀污泥(圖 4( b) ) ,并伴有污泥上浮隨出水流出,導致厭氧顆粒污泥發酵系統崩潰。

2. 3 酸化對系統發酵類型的影響
隨著有機負荷的提高,系統內部可能已經發生了一些變化,但是僅從 pH、堿度和 COD 去除率來看,在系統酸化之前并沒有明顯變化。 實驗中測定了系統液相末端產物( VFAs 和乙醇)的變化(結果如圖 5所示) ,當進水 COD 濃度增至 12 000 mg·L - 1后,液相末端產物總量逐漸提高,在酸化之前達到了最高點7 094 mg·L - 1。 在酸化后,液相末端產物總量迅速下降,在恢復階段雖有所增加,但最終仍然低于酸化前水平。
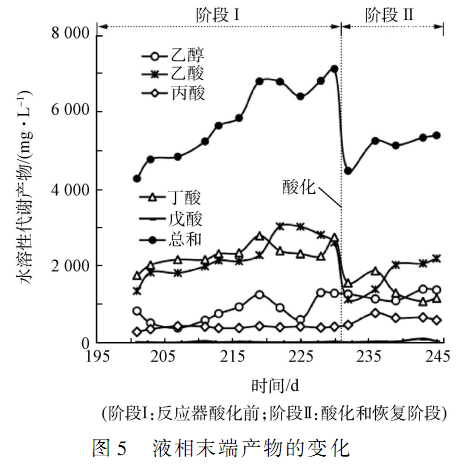
在酸化前,乙酸和丁酸為主要的液相末端產物,乙酸和丁酸濃度之和占總液相末端產物 72% ~83% ,而乙醇和乙酸之和所占比例為 46% ~ 61% ,說明在酸化前系統為丁酸型發酵。 在酸化之后,乙酸和丁酸的濃度都先呈現出下降的趨勢,后隨著恢復措施采取,乙酸濃度有所上升,而丁酸的體積分數始終保持較低水平。 而酸化后,乙醇的濃度開始出現上升,最終和丁酸維持在同一水平。 丙酸的濃度有所增加,最終穩定在 600 mg·L - 1。 在酸化后,乙酸和丁酸濃度之和所占比例為 59% ~ 65% ,而乙酸和乙醇之和占 49% ~ 66% ,丙酸和乙酸也占到 36%~ 52% ,說明系統處于混合酸發酵類型。 與傳統的厭氧發酵系統相似,過酸化的低 pH 值厭氧系統中易于發生丙酸積累。
酸化之前,系統液相末端產物總量有上升趨勢;酸化之后,系統液相末端產物急劇下降,這是因為過酸化階段較低的 pH 對反應器內微生物活性有抑制作用,所以酸化后代謝產物相應地減少。 另外,酸化將系統的發酵類型從丁酸型轉化為混合酸發酵類型,其產氫能力低于丁酸型發酵的產氫能力;另一方面,混合酸發酵會使系統中丙酸濃度增加,不利于產甲烷階段的進行和有機物的去除。 由此可見,酸化不利于系統維持相對高效的發酵類型。
2. 4 酸化對系統產氣的影響
在目前的研究中,低 pH 值的厭氧發酵系統主要用于生物制氫,其較適宜的 pH 為 4. 2 ~ 4. 5。 隨著系統的長期運行和顆粒污泥的出現,系統也產生了甲烷氣體。 一方面可能是由于顆粒污泥的特殊結構,內部 pH 能夠滿足甲烷細菌的生長需求;另一方面,也可能是系統中存在耐酸的產甲烷細菌。
如圖6( a)所示,在顆粒污泥系統酸化前的穩定階段,系統總產氣速率約為2 100 mmol·( L·d) - 1,其中氫氣約占 10% ,甲烷約占 15% 。 氫氣產率為(195 ± 20 ) mmol·( L·d) - 1甲烷的產率為( 320 ± 35 )mmol·( L·d) - 1(圖 6( b) ) 。
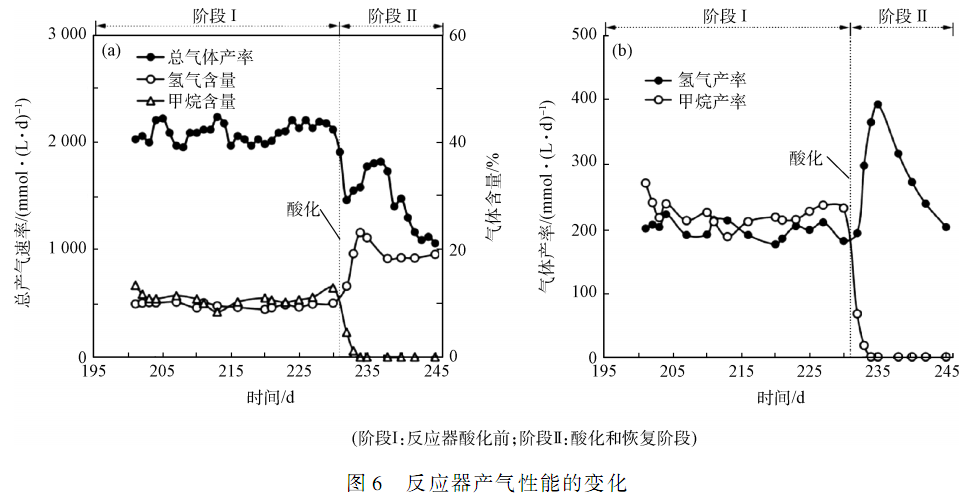
從圖6( a)可以看出,酸化后,總產氣速率急劇下降,最小值降為1 056 mmol·( L·d) - 1。 通常較高的有機負荷有利于提高發酵系統產氣速率,在第 245 天后,雖然作者提高了進水有機負荷,但總產氣速率仍然未能恢復。 酸化后,甲烷體積分數和產甲烷速率迅速下降,最終系統未檢測到甲烷的產生。 氫氣產量的變化趨勢則是當發生酸化時氫氣的體積分數呈現先上升后下降,最終穩定在(20 ± 3)% 。 而氫氣和甲烷產率在酸化初期有一定的上升趨勢,后來呈現出下降的趨勢,其下降主要是由于總產氣速率下降所致(圖6( b) ) 。 總產氣速率下降的原因是在酸化階段 pH 低于 4. 0 系統中所有的微生物的活性都受到了抑制。 甲烷體積分數和甲烷產率最終均降至 0。 從 2. 3 節可以看出,系統發酵類型從相對高效發酵類型(丁酸發酵類型)轉變為相對低效的類型(混合酸發酵類型) ,但是氫氣體積分數和產率在剛酸化時卻增加了。 氫氣產量的增加不是由于系統轉變為更加高效的發酵類型,而是因為產甲烷細菌被抑制造成的。 產甲烷細菌可以利用氫氣和發酵中間代謝產物產生甲烷,因產甲烷細菌受到抑制,減少了氫氣的消耗量,所以酸化初期系統的氫氣體積分數和氫氣產率都有較大的提升。 氫氣產率在經過短暫上升后,有持續下降的趨勢。 實驗結果可以看出,過酸化會抑制厭氧發酵系統總產氣速率,并抑制產甲烷活性。
2. 5 酸化后系統微生物群落分析
本實驗微生物群落分析的主要目的是初步了解酸化后系統中各種類型微生物的分布(在微生物分類過程中只鑒定到屬,未鑒定到種,因此只是一個大致的分類) 。 酸化后系統中典型的微生物在屬級別的組成和分布情況如表 2 所示。 總產氫微生物的比例之和占 37. 3% ,非產氫微生物比例之和占 54. 7% ,其他占8% 。 產氫微生物中,乙醇型產氫細菌(Ethanoligenens sp. 、Ruminococcaceae Incertae Sedis sp. 和 Raoultellasp. ) 、丁酸型發酵產氫細菌( Clostridium sp. 、Pectinatus sp. 和 Thermoanaerobacterium sp. )和丙酸型發酵產氫細菌(Megasphaera sp. )的比例分別為 13. 6% 、19. 6%和 4. 1% 。 非產氫細菌中,主要代謝產物為乙酸和乳酸的細菌( Prevotella sp. 、Lactobacillus sp. 、Bifidobacterium sp. 和 Lactococcus sp. )總共占了 53. 7% ,其中Prevotella sp. 占 26. 4% ,Lactobacillus sp. 占 25. 2% ,還檢測到 Dialister sp. 和 Acetobacter sp. 的存在。 產氫微生物中,乙醇型產氫細菌、丁酸型產氫細菌和丙酸型細菌共存,可以看出系統為混合酸發酵類型,與 2. 3 處酸化后的發酵類型保持一致。 從酸化后系統產氫微生物所占的比例和發酵類型上看,酸化后的系統并不適合以產氫為目的的厭氧發酵污水處理。
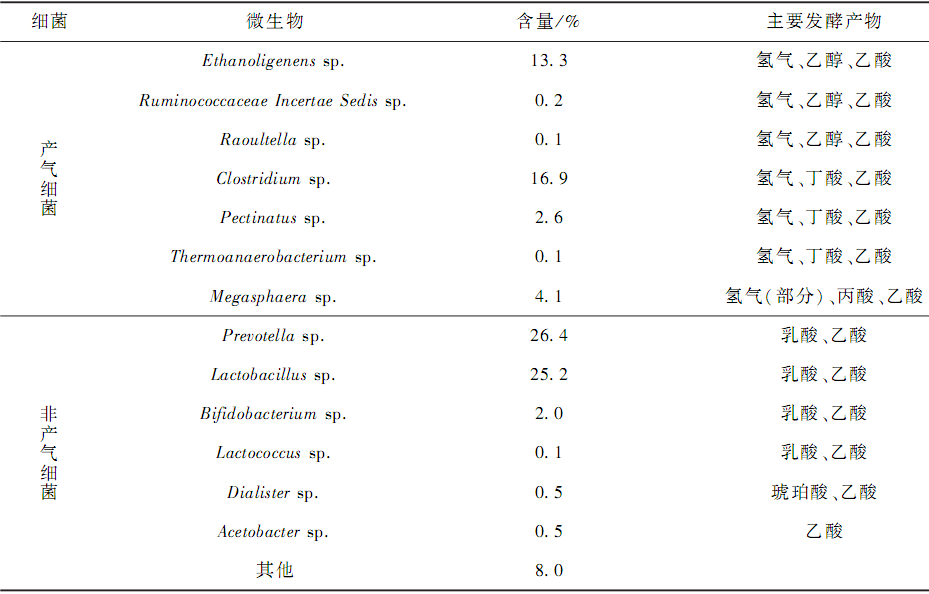
酸化后并沒有檢測到產甲烷細菌。 酸化之前,在負荷為 58. 8 kg·(m3·d) - 1,HRT 為 4. 9 h 的情況下,該系統的 COD 去除率為 20% ~ 25% ,除產氫過程利用了部分 COD 外,產甲烷細菌利用中間代謝產物(揮發酸和醇類)生成甲烷的過程降解了大部分 COD。 因為過酸化不但使產氫菌受到影響,還完全抑制了產甲烷菌,所以 COD 去除率無法恢復到之前水平。 此處的微生物檢測結果可以很好地解釋 2. 2 中COD 去除率的下降和 2. 4 中甲烷產量的下降。 LIU 等研究獲得了產氣和廢水處理效果較好的厭氧顆粒污泥,微生物分析結果顯示:同時檢測到產甲烷細菌 ( Methanomicrobiales ( 58. 4% ) 、 Methanobacterials(3. 3% )和 Methanococcales (1. 0% ) ) 、丁酸型發酵產氣細菌(Clostridium sp. (27. 3% ) )和非產生物氣細菌(Desulfovibrio sp. (9. 4% ) )的存在,其發酵類型為丁酸型發酵。 其中產氣細菌(產甲烷細菌和產氫細菌)為優勢微生物,而在本研究中,酸化以后產氣細菌僅占 37. 3% ,未檢測到產甲烷細菌的存在,且發酵類型為非高效產氣的混合酸發酵類型。 因此,酸化后系統微生物類型不適合厭氧發酵處理廢水同時回收生物氣。具體參見污水寶商城資料或http://www.bnynw.com更多相關技術文檔。
3 結論
本文研究了顆粒污泥低 pH 值厭氧發酵系統中,由有機負荷增高而導致的酸化沖擊對系統的影響。主要結論如下:
1)酸化沖擊對低 pH 值厭氧發酵系統有嚴重危害,表現為直接長期抑制系統產甲烷活性,后續產氫能力不穩定,同時導致顆粒解體和污染物去除能力下降。
2)酸化會導致厭氧發酵類型發生變化,本研究中發酵類型從丁酸型轉變為混合酸型,并發生丙酸積累,使系統不適合以產氫為目的的高濃度有機廢水處理并在后續進行產甲烷能源回收過程。
3)酸化會導致低 pH 值厭氧發酵系統的微生物種群發生變化,非產氫發酵細菌為優勢細菌(54. 7% ) ,而產氫細菌所占比例較少(37. 3% ) ,未檢測到產甲烷細菌存在。