碘代消毒副產物是在水中含碘離子或含碘化合物的條件下,利用次氯酸鈉,二氧化氯等消毒劑對飲用水或者污水進行消毒,與水中其他的化合物經過一系列復雜的反應生成的一類含碘的副產物。碘代消毒副產物的種類包括碘代三鹵甲烷,碘代鹵乙酸,碘代鹵乙腈,碘代乙酰胺等。碘代消毒副產物雖然在水中含量較低,但是大量的研究表明,其具有比常規(guī)的氯代和溴代消毒副產物更高的遺傳毒性和細胞毒性。我國的沿海地區(qū)和部分內陸地區(qū)水源中含有較高含量的碘離子,特別是北京、河南和河北部分淺層水中碘離子的含量高達1000µg·L−1,具有較高的碘代消毒副產物生成風險。目前,針對碘代消毒副產物的控制研究大多集中在利用傳統(tǒng)的混凝、沉淀,臭氧以及膜過濾等手段去除其前驅物,而對于碘代消毒副產物本身的降解研究較少。
高級氧化技術是一種處理難降解有機廢水的有效手段。芬頓氧化技術是應用最廣泛和成熟的高級氧化技術,在處理印染、醫(yī)藥、石化等行業(yè)廢水有重要的應用。但是傳統(tǒng)的均相芬頓氧化技術還存在著pH適用范圍窄、雙氧水利用效率低以及存在鐵泥二次污染等問題。多相芬頓催化氧化是近年來快速發(fā)展的一種改進型高級氧化技術,其目的在于克服均相芬頓技術的弊端。多相芬頓催化氧化主要是將自由的金屬離子固相化,形成金屬、金屬氧化物、金屬負載型以及金屬離子摻雜型固體催化劑。相比于傳統(tǒng)的均相催化氧化技術,多相芬頓催化技術具有pH響應范圍寬,不產生二次污染以及活性組分易分離的優(yōu)點。但是,固液界面的存在使得多相芬頓催化氧化反應受到催化劑結構形貌、表面性質等自身特性影響,還受到污染物特性,氧化劑種類和濃度等反應條件的影響,其催化機理在當前尚未形成統(tǒng)一的認識,這極大增加了催化劑結構設計以及活性調控的難度。這些催化劑的設計與調控大多依賴于催化劑內金屬組分高價態(tài)與低價態(tài)之間的轉換。因此,還存在著氧化劑利用率低,中性條件下催化效果不理想以及催化劑穩(wěn)定性差等不足。
雙反應中心(dual-reactorcenters,DRCs)催化劑是指通過在催化劑表面進行電子調控,構建具有貧富電子微區(qū)的雙反應中心(DRCs),使得富電子中心可以為O2,H2O2等氧化劑提供電子,發(fā)生還原反應,生成活性氧物種(包括·OH,O2·−等)。而缺電子中心則可以快速捕獲體系中的污染物等作為電子供體,實現污染物多途徑降解,并且兩個中心之間通過化學鍵橋實現電子高效轉移。利用雙反應中心原理構建的催化劑實現了突破了傳統(tǒng)芬頓反應利用金屬離子高低價態(tài)轉換來實現H2O2的氧化還原,有效突破了反應的速率限制步驟,提高了H2O2的利用率,也大大提高了催化劑的穩(wěn)定性。有研究表明,利用陽離子-用鍵是構建高效雙反應中心催化劑關鍵。比如,通過在CuAlO2催化劑表面嫁接CN(C3N4)有機配體,形成了C-O-Cu鍵橋,CN的引入一方面減少了CuAlO2的氧空穴的數量,另一方面大大的加速了電子在以C和Cu為貧富中心之間的傳遞,從而使得催化劑對雙酚A的降解效率提高了25倍以上。但嫁接有機配體的方式存在有機配體脫落的風險,如何優(yōu)化催化劑的合成方法,快速制備高效的雙反應中心催化劑具有重要的意義。
之前的研究發(fā)現,氧空位的存在可以在一定程度上影響芬頓反應的發(fā)生,其對電子的轉移以及污染物的捕獲都有重要的意義。ZHAN等人將氧化鈷摻雜到氧化鋅(ZnO)纖鋅礦晶格中,成功地在催化劑表面構建了富含未配對電子的氧空位富電子中心和Co(III)貧電子中心,催化效率提高了17倍以上。也有研究表明,銅系類芬頓催化劑在催化芬頓反應時,比鐵系類芬頓催化劑具有更高的反應速率和更寬的pH適用范圍。這是因為Cu(II)被過氧化氫催化還原的速率(1.0×104mol·s−1)要遠高于Fe(III)(74mol·s−1)。但是大部分的銅基的催化劑在污染物或者酸的作用下(0.5~10mg·L−1),容易發(fā)生泄露,高于美國飲用水標準1.3mg·L−1,從而造成一定的環(huán)境影響。因此,如何在保持銅元素高效催化效率的同時,提高銅元素的穩(wěn)定性對于催化劑的設計和開發(fā)就顯得尤為重要。
基于此,本文通過水熱合成的方法在ZnO纖鋅礦晶格中嵌入氧化銅(CuO),從而得到一種全新的雙中心反應催化劑。通過XPS,EPR,FTIR等手段對催化劑的表面性質進行表征。并利用水中典型的碘代消毒副產物碘乙腈進行降解研究,重點研究了碘乙腈降解效果,影響因素以及礦化效果,同時根據EPR,XPS的分析結果推測了碘乙腈的降解機制。
1、材料與方法
1.1 實驗材料
雙氧水(國藥集團化學試劑陜西有限公司,H2O2,30%)、氫氧化鈉(AR,96%)、碳酸氫鈉、磷酸氫二鈉合二水(Na2HPO4·2H2O,AR,99.0%~100.5%)、磷酸二氫鉀(KH2PO4,GR,99.5%~100.5%)、對苯醌(麥克林,AR,97%)、叔丁醇(CP,98%)、無水硫酸鈉(AR,99%)、甲基叔丁基醚(沃凱,MTBE)、2.5水合硝酸銅(98.0%~102.0%,Cu(NO3)2·2.5H2O,AlfaAesar)、六水合硝酸鋅(Zn(NO3)2·6H2O,98%,AlfaAesar)、超純水、氨水(AR,25%~28%)、碘乙腈(麥克林,98%,IAN),分子式C2H2IN。所有化學試劑至少是分析純,實驗用水為超純水。
1.2 催化劑的制備
按照設定的比例稱取一定量的六水合硝酸鋅和三水合硝酸銅溶于200mL超純水中,攪拌30min,向其中加入氫氧化鈉溶液,用氨水調節(jié)pH至堿性,150℃下反應8h。反應完成后,將產物過濾并清洗3遍,隨后將所得固體烘干后置于馬弗爐中550℃條件下煅燒,制得Cu-ZnO催化劑。
1.3 催化劑的表征
采用透射電子顯微鏡(TEM,日本JEOL公司JEM-2100型)觀察催化劑的微觀結構特征及構造;采用X-射線粉末衍射儀(XRD,PhilipsPW3040/60型)來觀察催化劑的晶型和物相;采用X射線光電子能譜(XPS,ThermoScientificK-Alpha+)對金屬元素價態(tài)和表面元素組成和含量信息進行收集,X射線源:單色化AlKa源(MonoAlKa)能量:1486.6eV,電壓:15kV,束流:15mA,分析器掃描模式:CAE。采用傅立葉變換紅外光譜儀(BRUKERVERTEX70型)來分析制備的催化劑表面官能團。通過電子順磁共振波譜儀(德國布魯克公司ESP300E型)測試固體催化劑的EPR信號。
1.4 實驗方法
取一定量的催化劑加入到預先配好的碘乙腈溶液中,充分攪拌后,立即加入過氧化氫溶液,反應時間為240min。分別在0、10、30、60、120、240min取樣,并過0.22μm水系濾膜過濾。碘乙腈溶液初始濃度為Co,反應后濃度為Ce,用Ce/Co表示碘乙腈的降解程度。過濾后的樣品加入3g無水硫酸鈉,擰緊瓶蓋后振蕩,直至無水硫酸鈉基本溶解,繼而用移液管加入2mLMTBE,擰緊瓶蓋后,振蕩1min、靜止5min后,吸取上層有機液,裝入2mL的進樣瓶,使用氣相色譜-質譜聯用儀GC-MS(島津,GC2010-TQ8040)分析。
1.5 分析方法
IAN的濃度通過GC-MS分析測定。色譜柱為SH-Rxi-5SilMS(L:30m,ID:0.25mm,DF:0.25μm);GC參數:柱箱及進樣口溫度分別是40℃和260℃,不分流進樣,進樣量1µL,載氣為氦氣;升溫程序為:40℃保持3min,隨后以20℃·min−1的升溫速率升至100℃,最后以40℃·min−1的升溫速率升至240℃保持3min,總程序時間為12.50min,離子源及接口溫度分別是220℃和260℃;采用外標法進行定量分析,得到標準曲線相關系數大于0.99;在此方法下:IAN的保留時間為5.860min,目標離子m/z為167,參考離子m/z分別為40和127。I−、IO3−采用離子色譜1100分析;色譜柱型號IC(AS-16,150mm×4mm)。TOC測試采用過總有機碳分析儀測定。Zn和Cu離子采用離子色譜質譜聯用儀(ICP-MS)測定。
2、結果與討論
2.1 催化劑的形貌及結構表征
Cu-ZnO的透射電鏡圖和元素能譜圖如圖1所示。由圖1(a)~(b)可以看出,Cu-ZnO催化劑為納米棒狀結構。由圖1(c)~(d)中可以看到明顯的晶格條紋,說明該催化劑具備銅摻雜的氧化鋅晶型。由圖1(e)~(h)可以發(fā)現,催化劑主要元素為鋅、銅和氧元素,并且銅元素均勻的分布在氧化鋅納米棒上。這說明銅和鋅形成了較好的鍵聯。由于鋅的電負性為1.65eV,銅的電負性為1.9eV。因此,在催化劑的表面可能形成銅富電子中心和鋅貧電子中心。兩者通過氧原子進行連接,并傳遞電子,捕獲周圍的污染物或者氧化劑發(fā)生氧化還原反應。

圖2為催化劑的FT-IR、XRD以及EPR圖譜。由圖2(a)可以看出,ZnO和Cu-ZnO表面均存在羥基官能團。對于ZnO來說,3485cm−1和1427cm−1分別歸屬于催化劑表面羥基的伸縮振動峰和面內振動峰。而Cu-ZnO的特征峰有明顯的紅移,羥基的伸縮振動峰和面內振動峰分別出現在3525cm−1和1431cm−1。這說明在Cu-ZnO中,由于銅元素的加入,影響了氧化鋅表面的電荷分布,從而影響了催化劑表面附著羥基的振動。XRD圖譜(圖2(b))中2θ為31.73º、36.20º、56.52º分別對應ZnO的(100)、(101)以及(110)晶面。2θ為35.47º、38.74º、48.82º分別對應CuO的(002)、(111)以及(202)晶面。這說明合成的催化劑基本保留了氧化鋅六方纖鋅礦的晶型結構。由于銅離子和鋅離子的原子半徑接近,因此,銅離子可以很好地摻雜到氧化鋅的晶型結構中。如圖2(c)所示,在引入Cu之后,EPR的自由電子信號顯著增強,說明催化劑表面電子發(fā)生重排,出現極化性的電子高低密度區(qū),有利于后續(xù)反應中與環(huán)境介質交換電子,發(fā)生氧化還原反應。
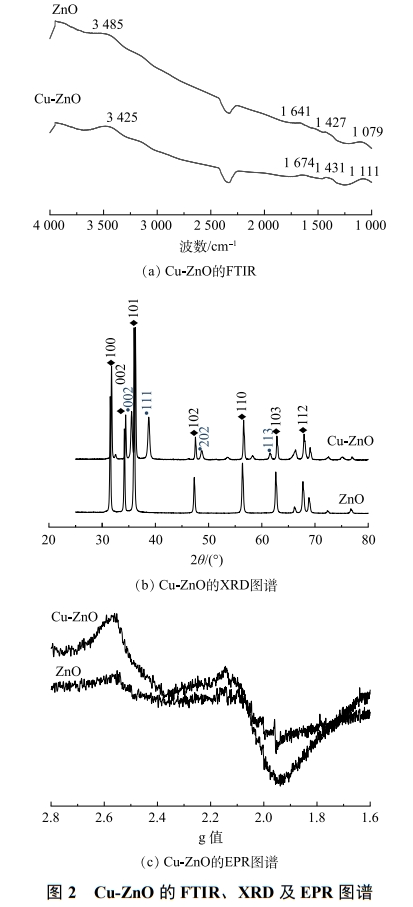
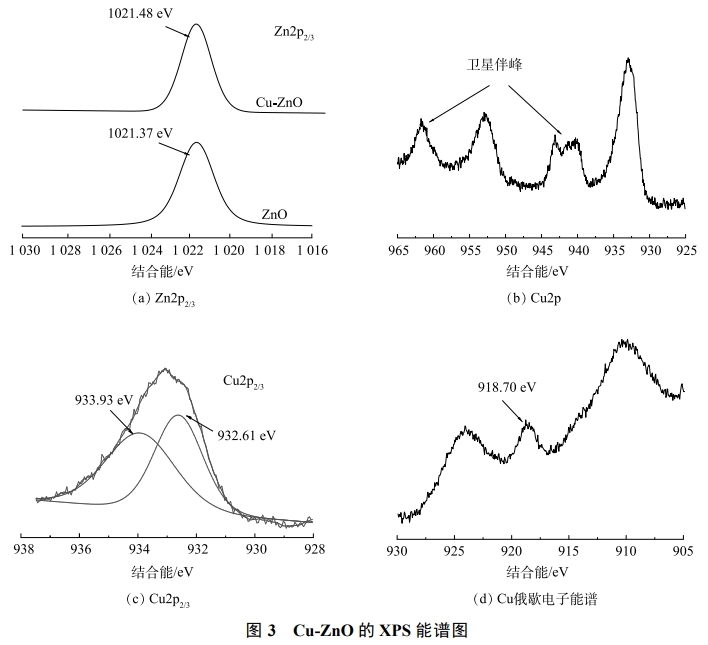
Cu-ZnO催化劑表面Cu和Zn的XPS表征結果如圖3(a)所示。可見,1021.48eV對應的是Zn的2p3/2光電子峰,相比于純的ZnO對比,Zn的電子結合能增加了0.11eV。這是因為銅原子的電負性要比鋅原子大,銅加入后Zn有給電子的傾向,從而使得鋅對于剩余電子束縛能力增強,結合能增大。如圖3(b)所示,Cu-ZnO催化劑中銅元素的光電子能譜在942~945eV和962eV附近有2個較強的衛(wèi)星峰,說明Cu主要以Cu(II)形態(tài)存在。使用Avantage軟件對Cu2p2/3圖譜進行分峰處理(圖3(c))。結果表明,可能存在2種形態(tài),932.61eV對應的是Cu0或者Cu+,933.91eV對應的是Cu2+。通過對CuLMM俄歇電子能譜的分析得知(圖3(d)),Cu的峰值在918.70eV左右,歸屬于Cu0。
2.2 碘乙腈降解效果
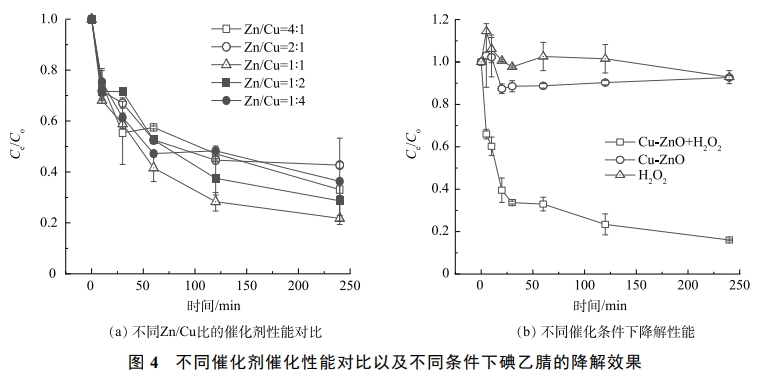
為了研究不同Cu/Zn配比條件下催化劑的降解效果,本研究合成了Zn/Cu原子比例為4∶1、2∶1、1∶1、1∶2、1∶4的5種催化劑,結果如圖4(a)所示。所有的催化劑都表現出了對碘乙腈良好的降解效果,當Cu/Zn為1∶1的時候,降解效果最佳。圖4(b)反映了在單獨雙氧水(10mmol·L−1),單獨Cu-ZnO催化劑(1g·L−1)以及催化劑+雙氧水(1g·L−1+10mmol·L−1)3個條件下碘乙腈的降解效果。單獨雙氧水和單獨催化劑對碘乙腈的降解效果有限,去除率小于20%。在催化劑投加量為1g·L−1,H2O2投加量為10mmol·L−1時,碘乙腈的去除率為84%。這說明合成的Cu-ZnO催化劑可能誘導H2O2產生·OH、O2·−等活性物質,從而降解水中的污染物。
為了優(yōu)化合成的Cu-ZnO催化劑降解碘乙腈的反應條件,研究了不同H2O2投加量,催化劑投加量,pH對碘乙腈降解效果得影響,同時研究了環(huán)境中的腐殖酸和共存離子的影響,實驗結果如圖5(a)~(e)所示。可以看出,隨著雙氧水投加量的增加,碘乙腈的降解速率有明顯的提升,但是當雙氧水的濃度增加到6mmol·L−1以上時,碘乙腈的去除率達到82%,并且不再上升。同時,當催化劑的濃度為10mmol·L−1時,再次提高雙氧水的濃度對碘乙腈的降解率和速率不再提升(圖5(a))。圖5(b)反映了催化劑投加量對碘乙腈去除效果的影響。可見,隨著催化劑的投加量的增加,碘乙腈的去除率和降解速率也有所增加。當催化劑的投加量達到1g·L−1時,碘乙腈去除率和降解速率增加不再明顯。因此,本次研究確定雙氧水和催化劑的最佳投加量分別為10mmol·L−1和1g·L−1。圖5(c)反映了不同pH條件下,催化劑對碘乙腈的降解效果,與大部分常規(guī)多相芬頓催化劑反應不同的是,在本次研究中當溶液的pH為酸性時(pH=3和5),碘乙腈的去除率較pH為中性或者堿性的時候低。一般地認為,在pH為酸性時,更有利于H2O2的還原和·OH的生成,從而更有利于污染物的降解。而本次合成的Cu-ZnO雙反應中心催化劑利用銅和鋅之間電負性的差異,在催化劑內部構建了多個具有正負極的微型原電池,從而實現了電子的快速轉移。相比于傳統(tǒng)的均相芬頓或者多相芬頓技術,基于雙反應中心催化理論設計的類芬頓催化劑本身對pH的依賴性較小。另一方面,對于污染物碘乙腈來說,在酸性條件下具有較好的穩(wěn)定性。當溶液pH上升,碘乙腈也更容易水解,在一定程度上促進了碘乙腈的降解。
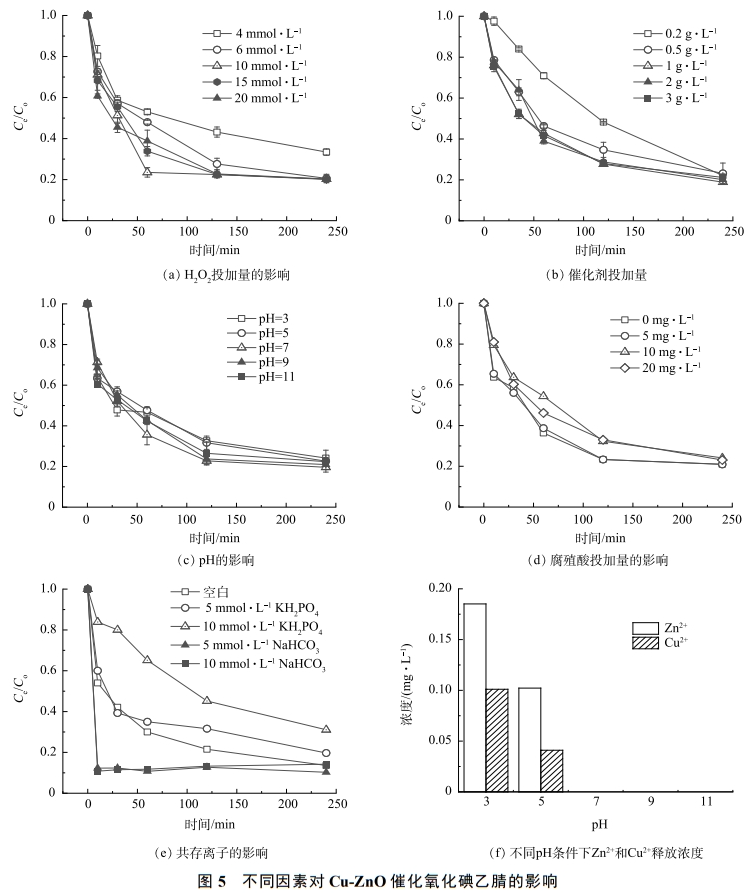
圖5(d)和圖5(e)反映了腐殖酸(HA)、磷酸根(PO43-)以及碳酸氫根(HCO3−)對碘乙腈去除率的影響。由圖5(d)可知,當HA的濃度小于5mmol·L−1時,碘乙腈的去除率不受影響。當HA的濃度高于10mmol·L−1時,碘乙腈的去除率降低。這可能是由于腐殖酸會吸附在催化劑的表面,從而減少了污染物和催化劑表面的接觸。從圖5(e)可以看出,磷酸根離子對碘乙腈的降解有抑制作用,而碳酸氫根對于碘乙腈的降解有促進的作用。當反應體系中磷酸根的濃度分別為5mmol·L−1和10mmol·L−1時,碘乙腈的去除率下降了分別為6.19%和18.11%。而當溶液中有碳酸氫根存在時,碘乙腈的降解速率大大加快了,10min內碘乙腈的去除率達到了80%。有研究表明,HCO3−由于對·OH有淬滅作用,因此,對大多數的多相芬頓催化劑有抑制作用。但在本次研究中,碳酸氫根對碘乙腈的降解基本沒有抑制作用,反而有促進作用。這可能是由于碳酸氫根可以吸附到催化劑的表面,從而為電子的轉移起到架橋的作用,從而加快了電子的轉移速率,具體的理論解釋需要進一步的實驗研究證明。
圖5(f)反映了在不同pH條件下催化劑的Zn2+和Cu2+的釋放情況。結果表明,在pH為酸性的時候,催化劑會釋放出少量的Zn2+和Cu2+,其質量濃度小于0.2mg·L−1,小于《城鎮(zhèn)污水處理廠污染物排放標準》(GB18918-2002)》的規(guī)定值(Zn≤1.0mg·L−1,Cu≤0.5mg·L−1)。當pH為中性時,幾乎觀察不到溶液當中的Zn和Cu。這表明催化劑具有良好的化學穩(wěn)定性和較為廣闊的應用前景。
2.3 碘乙腈降解途徑分析
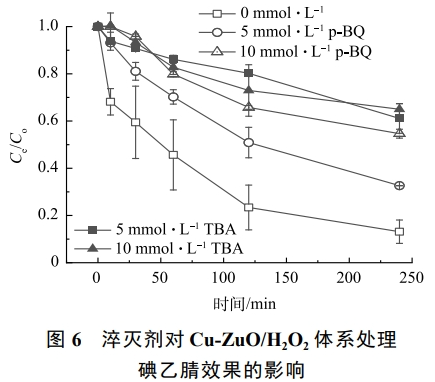
為深入探究自由基的產生類型以及對碘乙腈降解效果的影響,本次研究采用了叔丁醇(TBA)和對苯醌(p-BQ)2種淬滅劑分別對體系中可能產生的·OH和O2·−進行淬滅,結果如圖6所示。2種淬滅劑對碘乙腈的降解有明顯的抑制作用,尤其是叔丁醇。當叔丁醇的投加量為5mmol·L−1時,碘乙腈的去除率降低了64%,再次提高叔丁醇的投加量,對碘乙腈降解的抑制作用不再增強。而p-BQ的投加量為5mmol·L−1和10mmol·L−1時,碘乙腈的去除率由91%下降到33%和22%。這說明·OH和O2·−都對碘乙腈的降解有重要的作用,并且·OH的影響更大。
為進一步探究自由基的產生機理,采用ESR技術考察了在不同條件下HO2/O2·−的生成情況,結果如圖7(a)和圖7(b)所示。可以發(fā)現,在只有催化劑的存在的情況下,在體系中可以捕捉到HO2/O2·−的信號,但沒有檢測到·OH。這是因為催化劑本身富電子區(qū)就能活化氧氣產生HO2/O2·−。在加入污染物后,可以看到·OH的信號明顯增強。這說明污染物加入后,可以作為催化劑表明雙中心反應的電子供體,提高了催化劑內部的電子傳遞速率,從而促進·OH的產生。產生的·OH可以進一步對碘乙腈進行氧化,提高體系的催化效率。
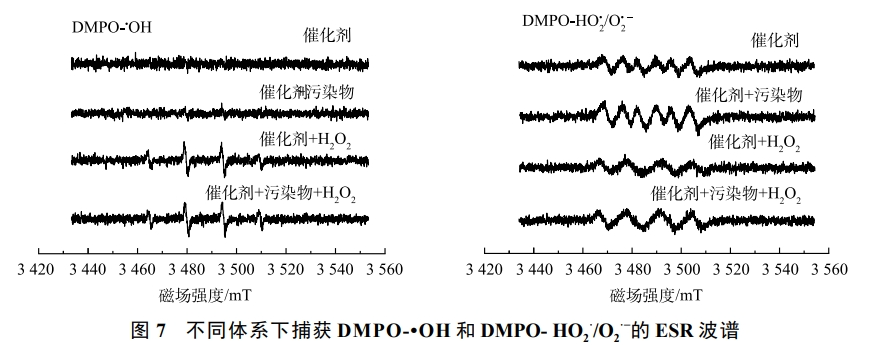
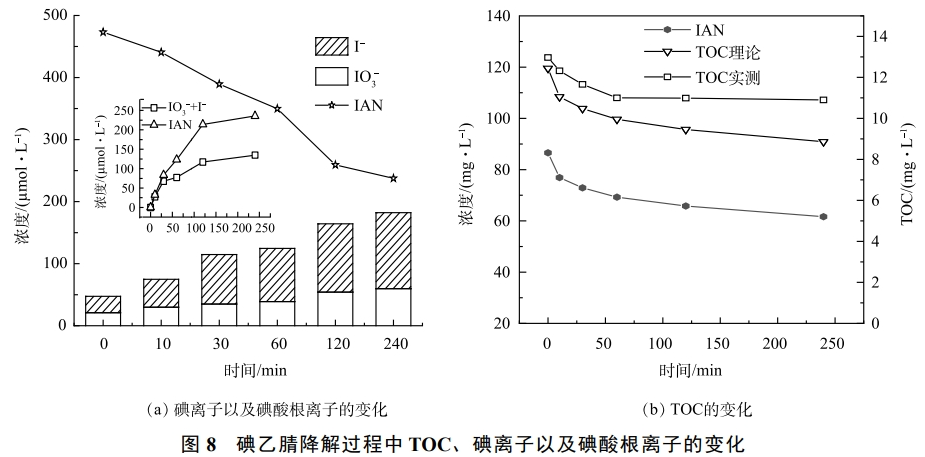
圖8反映了催化反應過程中I-和IO3−的生成量變化趨勢。由圖8(a)可知,隨著IAN的降解,反應體系中I-和IO3−的質量濃度逐步上升。有研究表明,當水中的碘化物降解時,會釋放出I-或者含碘的降解產物。當體系中有氧化劑存在時,碘離子可以被氧化生成氫碘酸(HOI)。氧化生成的HOI在水中不穩(wěn)定,會繼續(xù)發(fā)生以下2種路徑:一方面會繼續(xù)發(fā)生歧化反應生成碘離子和碘酸根,生成的碘酸根離子是無毒的,且化學性質穩(wěn)定,對環(huán)境的影響較小,被認為是水中碘元素演變的理想歸宿;另一方面,當水中有天然有機物(NOM)存在時,HOI可以繼續(xù)生成含碘的副產物,這也是水中含碘消毒副產物的主要來源。在本研究中發(fā)現,雖然隨著IAN的降解I-和IO3−的質量濃度都在上升,但生成的I-和IO3−的數量要小于IAN的降解量。這說明雖然在碘乙腈降解的過程中,碘乙腈并沒有完全礦化,還生成了其他含碘的降解產物。為了更深入研究IAN礦化程度,本研究檢測了在降解過程中TOC的變化規(guī)律,實驗結果如圖8(b)所示。理論計算的TOC濃度(TOC理論)根據反應后體系中剩余的IAN的濃度理論計算而來,計算公式如式(1)所示。TOC實測為體系中實測的TOC濃度。結果表明,隨著IAN的不斷降解,反應后體系中TOC的濃度也在逐漸降低,這說明有部分的IAN已經被完全礦化。同時,本研究也觀察到實測的TOC濃度要大于體系中IAN所產生的TOC濃度。這說明,被降解的IAN并沒有全部礦化生成二氧化碳和水,仍然存在部分有機中間產物。這部分中間產物可能包括碘乙酰胺,碘乙酸以及含碘甲烷等。

式中:C理論為理論計算的TOC的濃度,mg·L−1,Ce為反應后碘乙腈的濃度,mg·L−1,M1為碳元素的摩爾質量,g·mol−1,M2為碘乙腈的摩爾質量,g·mol−1。
綜上所述,推斷了采用Cu-ZnO降解碘乙腈的雙中心反應機制(圖9)。首先,由于在催化劑內部鋅和銅的電負性差異,形成了以銅富電子中心和以鋅貧電子中心,2個中心通過氧原子鍵聯,電子經Cu-O-Zn鍵橋傳遞。在H2O2存在的條件下,H2O2分子在富電子中心得電子還原產生·OH,從而氧化降解水中的碘乙腈。同時,碘乙腈可以作為電子供體圍繞在貧電子鋅中心周圍,一方面,可以為催化反應提供電子從而自身發(fā)生氧化降解;另一方面,也在一定程度上阻隔H2O2的無效分解。多數碘乙腈在·OH的作用下礦化成CO2和H2O,碘離子最終降解成I-和IO3-;部分未能被礦化的碘乙腈可能生成碘乙酸、碘乙酰胺以及碘仿等副產物。

3、結論
1)通過水熱合成的Cu-ZnO雙反應中心納米催化劑成功的將Cu摻雜到ZnO的晶格中,其具有良好的催化活性,能夠有效地去除水中的碘乙腈。
2)當Cu-ZnO投加量為1g·L−1,雙氧水投加量為10mmol·L−1時,Cu-ZnO對碘乙腈的去除率可達91%以上。
3)pH和低濃度的HA對催化降解效果影響較小,高濃度的HA和磷酸氫根有抑制作用,碳酸根濃度大于0.3mmol·L−1時對碘乙腈的去除速率和去除率均有促進作用。
4)·OH和HO2/O2·−是降解碘乙腈主要的活性物種,降解產物包括I-、IO3−、CO2、水等產物。(來源:西安理工大學省部共建西北旱區(qū)生態(tài)水利國家重點實驗室,中國電建集團西北勘測設計研究院有限公司)



