污水再生回用能夠有效緩解城市水資源短缺的問題,目前我國污水處理廠主要采用“混凝-沉淀-過濾”深度處理工藝。為了解決此傳統工藝處理流程較長和對溶解性有機物的去除率較低的問題,筆者所在課題組構建了臭氧混凝耦合反應體系(HOC),將臭氧氧化與混凝放在同一體系內,使兩者互促增效,可促進臭氧分解生成更多的羥基自由基(·OH),進而提高對溶解性有機物的去除率。由于工業和油田的鹽水排放以及農作物肥料甲基溴的使用等,部分地區的污水處理廠二級出水中Br濃度高達500~1000μg/L。當采用HOC工藝處理此類二級出水時,由于體系中臭氧氧化與·OH氧化的存在,加之初始Br濃度較高,生成溴酸鹽(BrO3-)消毒副產物的風險較高。BrO3-為2B級潛在致癌物質,且在自然水體中非常穩定,一旦生成難以去除,因此,為了進一步評價HOC工藝的適用性并推廣其應用范圍,研究HOC工藝中BrO3-的生成特性,探索HOC體系的最佳工藝條件顯得至關重要。
筆者對比了HOC工藝與單獨臭氧氧化工藝對二級出水中有機物的去除特性以及處理過程中急性毒性的變化;通過分析溴類物質的濃度變化情況,探究HOC工藝中BrO3-的生成特性,進而明確HOC工藝的最佳反應條件;通過對臭氧自分解的一級動力學方程的擬合與·OH生成速率的分析,揭示HOC工藝中BrO3-的生成途徑貢獻率,以期為HOC體系中溴酸鹽消毒副產物的有效控制提供參考。
1、材料與方法
1.1 實驗用水
實驗用水為純水與污水廠二級出水加KBr,Br濃度為500μg/L,其中二級出水來自西安市某污水處理廠A2/O工藝的二沉池出水,具體水質指標如下:pH為7.34±0.18,總有機碳(TOC)為(4.576±1.236)mg/L,Br為(110±5)μg/L。
1.2 實驗裝置
HOC實驗裝置如圖1所示,反應器為有機玻璃瓶,通過氣體流量計控制氧氣源臭氧發生器向反應體系中持續穩定通入臭氧,未反應的臭氧氣體通入KI吸收瓶。
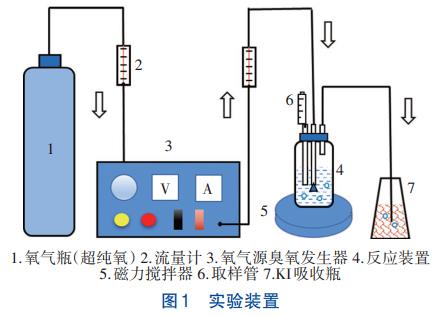
飽和臭氧水的制備裝置同圖1,只是把磁力攪拌器換為冰浴鍋。通過氣體流量計控制氧氣源臭氧發生器出口流量在16L/h左右,利用冰浴鍋控制溫度在4℃左右,持續曝氣約2h,臭氧即可達到飽和。
1.3 實驗方法
HOC實驗反應體系為100mL的超純水或二級出水,向體系加入2mmol/L的磷酸鹽緩沖液,采用0.2mol/L的NaOH溶液和(1+9)H2SO4溶液調節pH至5±0.2、7±0.2和9±0.2,混凝劑氯化鋁與硫酸鋁的投加量均為15mg/L(以Al計)。實驗開始前,將反應體系置于磁力攪拌器上預先進行攪拌,加入混凝劑后立刻開始計時,快攪1min(轉速為500r/min),結束后迅速向體系中通入臭氧,同時慢攪10min(轉速為100r/min),并在設定時間取樣,氮吹以防止其進一步氧化。
探究BrO3-的生成途徑貢獻率時,采用將飽和臭氧水投加到封閉體系的方法,即在混凝快攪完成后快速加入飽和臭氧水,飽和臭氧水的投加量為4.5mg/L(即1.0mg/mg,以TOC衡量),反應時間為15min。從加入飽和臭氧水開始計時,并在設定時間取樣,經0.45μm濾頭過濾后,快速測定臭氧濃度。測定對氯苯甲酸(p-CBA)濃度時還需提前向反應體系中加入0.5μmol/L的p-CBA,并需提前在液相小瓶中加入0.025mol/L硫代硫酸鈉淬滅·OH。
1.4 分析項目與方法
臭氧濃度:液態臭氧濃度采用靛藍比色法測定,氣態臭氧消耗量采用碘量法測定。
TOC濃度:采用TOC-VCPH總有機碳分析儀(日本島津)測定,測定前樣品需經H2SO4酸化并用氮氣吹脫3min,以去除水樣中的大部分無機碳,保證測定結果的準確性。
Br和BrO3-濃度:采用ICS-1100Dionex型熱電陰離子色譜儀測定,色譜柱為DionexIonPacTMAS23(4mm×250mm),BrO3-的檢測限為3μg/L;樣品使用固相萃取裝置進行預處理,采用BondElut-C18小柱去除有機物的干擾,采用DionexOnGuardTMⅡAg/H小柱去除過渡金屬離子與氯離子的干擾。
HOBr/BrO濃度:采用苯酚衍生法測定,即樣品與苯酚在pH=3條件下于70℃水浴中加熱1h后,采用高效液相色譜法測定4-溴苯酚濃度,4-溴苯酚的檢測限為0.6μg/L。
·OH濃度:通過添加p-CBA作為·OH捕獲劑來間接測定·OH濃度,p-CBA濃度采用高效液相色譜法測定,使用紫外檢測器,色譜柱為大連依利特5μm反相C18柱(4.6mm×250mm),最低檢測限為0.1μg/L。
急性毒性:使用生物發光檢測儀檢測樣品對費氏弧菌(V.fischeri)的發光抑制性,通過發光抑制率來表示樣品的毒性。毒性檢測標準采用ISO11348標準,實驗采用苯酚作為陽性對照、2%的NaCl溶液作為空白對照。
2、結果與討論
2.1 HOC工藝的處理特性
2.1.1 對二級出水中有機物的去除效果
當臭氧投加量為1.0mg/mg時,不同pH條件下單獨臭氧氧化工藝、HOC工藝(硫酸鋁)、HOC工藝(氯化鋁)對二級出水中有機物的去除效果如圖2所示。
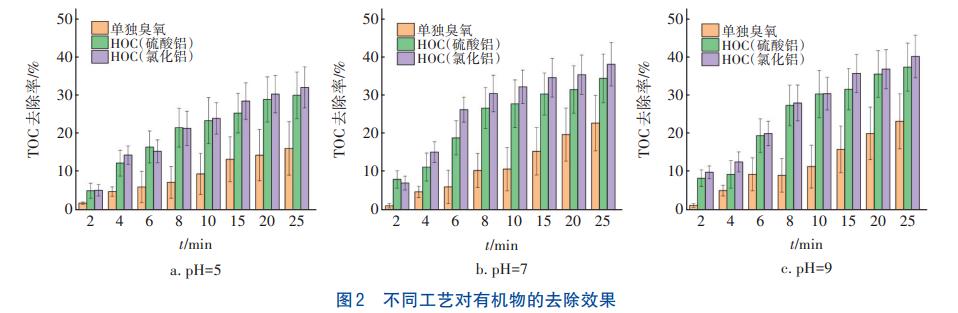
從圖2可以看出,HOC工藝相比單獨臭氧氧化工藝對有機物的去除效果更優,在pH=5、7和9條件下反應25min后HOC工藝(氯化鋁)對有機物的去除率分別為32.0%、38.3%和40.3%,相較于單獨臭氧氧化工藝分別提升了15.9%、16.8%和17.2%,這是由于HOC工藝產生了更多的·OH,·OH可無選擇性地與有機污染物反應從而提高了去除率。HOC工藝(氯化鋁)對有機物的去除率整體高于HOC工藝(硫酸鋁),這可能是由于混凝劑氯化鋁的水解產物相較于硫酸鋁的水解產物表面羥基更豐富,而臭氧主要和混凝劑水解產物的表面羥基反應,表面羥基豐富則產生的·OH就更多,對有機物的去除效果就更好。
2.1.2 急性毒性的變化
污水廠二級出水的pH大多在7左右,所以該實驗在pH=7條件下,研究三種工藝處理二級出水過程中急性毒性的變化情況,結果見圖3。
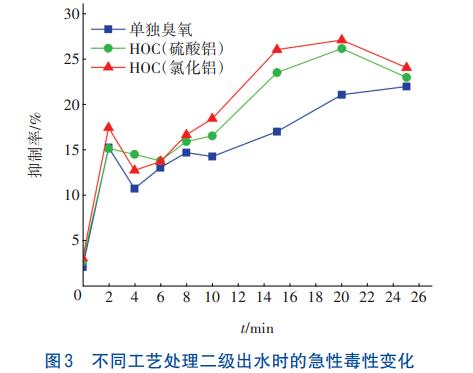
從圖3可以看出,二級出水對發光細菌的抑制率隨著反應的進行先略微降低后逐漸增加,其中HOC工藝的抑制率最高達到了27%,毒性較強。結合圖2可知,隨著二級出水中有機物濃度的降低,急性毒性增強,這可能與水中溴酸鹽消毒副產物的生成有關。反應10min后HOC工藝(氯化鋁)對二級出水中有機物的去除率為32.4%,比反應25min的去除率僅低了5.9%,且反應10min時毒性較低,所以綜合考慮后,確定最佳反應時間為10min。
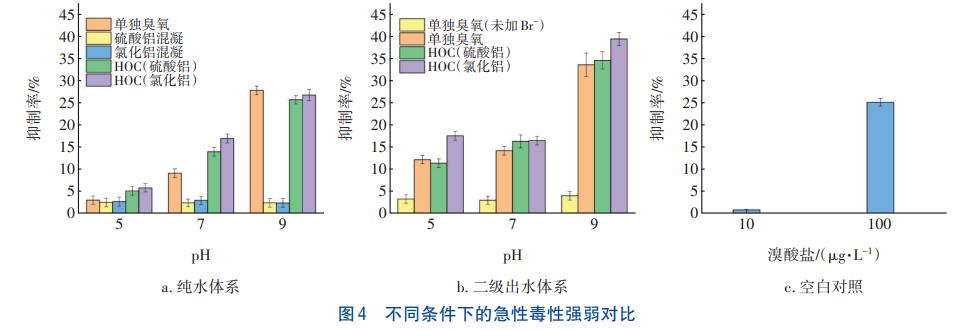
為探究二級出水深度處理過程中急性毒性增強的原因,實驗在pH=5、7和9,臭氧投加量為1.0mg/mg條件下,對不同工藝反應10min后的急性毒性強弱進行比較,并在純水中加入不同濃度的溴酸鹽,測定其急性毒性作為空白對照,結果見圖4。由圖4(a)和(b)可知,隨著pH的增大,兩種體系中BrO3-生成量增大,急性毒性明顯增強。純水體系經過氯化鋁單獨混凝工藝和硫酸鋁單獨混凝工藝處理后,對發光細菌的抑制率都在3%左右,毒性極低,但經HOC工藝處理后水體的毒性都較強,所以投加混凝劑對毒性強弱的影響很小。由圖4(b)可知,有機物濃度相同的二級出水經單獨臭氧氧化處理后,初始Br濃度高的水體毒性明顯較高,表明有機物濃度對毒性強弱的影響較小。如圖4(c)所示,高濃度(100μg/L)溴酸鹽的急性毒性較高,對發光細菌的抑制率達到了25.13%,而低濃度的溴酸鹽的毒性幾乎為0,說明溴酸鹽濃度變化能夠引起急性毒性的變化。綜上可知,BrO3-消毒副產物是影響毒性強弱的主要原因。
2.2 HOC工藝中溴酸鹽的生成特性
2.2.1 不同反應條件對溴酸鹽生成的影響
在不同pH和臭氧投加量下,采用三種工藝分別處理純水與二級出水10min,BrO3-的生成情況見圖5。可知,BrO3-的生成量隨著pH的增加與臭氧投加量的增加而逐漸升高。氧化劑含量是BrO3-生成量的主要影響因素,臭氧投加量的增加與pH升高會影響臭氧的自分解反應,有利于臭氧分解產生更多的·OH,進而促進BrO3-的生成。通過對比可知,HOC工藝中的BrO3-生成量明顯大于單獨臭氧氧化工藝,且HOC工藝(氯化鋁)大于HOC工藝(硫酸鋁),這是因為HOC工藝中混凝劑通過水合作用在其表面產生大量羥基官能團,其中氯化鋁產生的表面羥基更豐富,能生成更多的·OH。
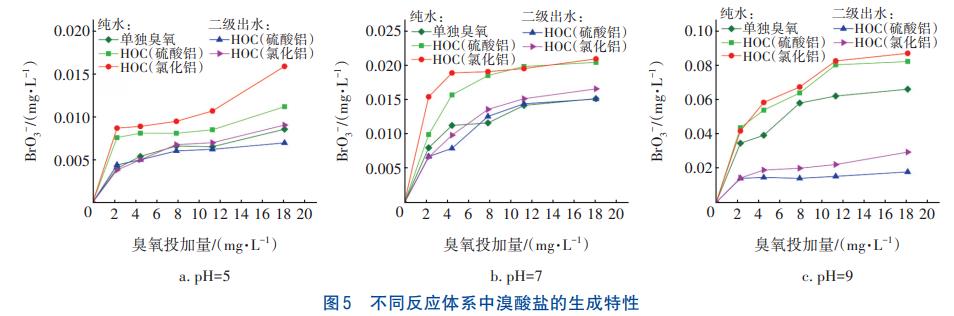
對比純水體系,二級出水體系中BrO3-的生成量明顯減少,這是由于二級出水中的有機物與Br存在競爭關系,抑制了BrO3-的生成。HOC工藝處理二級出水時臭氧投加量不宜過高,當投加量低于2.0mg/mg時BrO3-的生成量相對較低。《生活飲用水衛生標準》(GB5749—2006)規定BrO3-濃度不高于10μg/L,在pH=5條件下采用HOC工藝處理二級出水時,BrO3-的生成量可以滿足GB5749—2006的要求,當pH=7和9時仍需要通過控制其他反應條件來保證HOC工藝出水水質的安全性。
2.2.2 溴酸鹽生成途徑
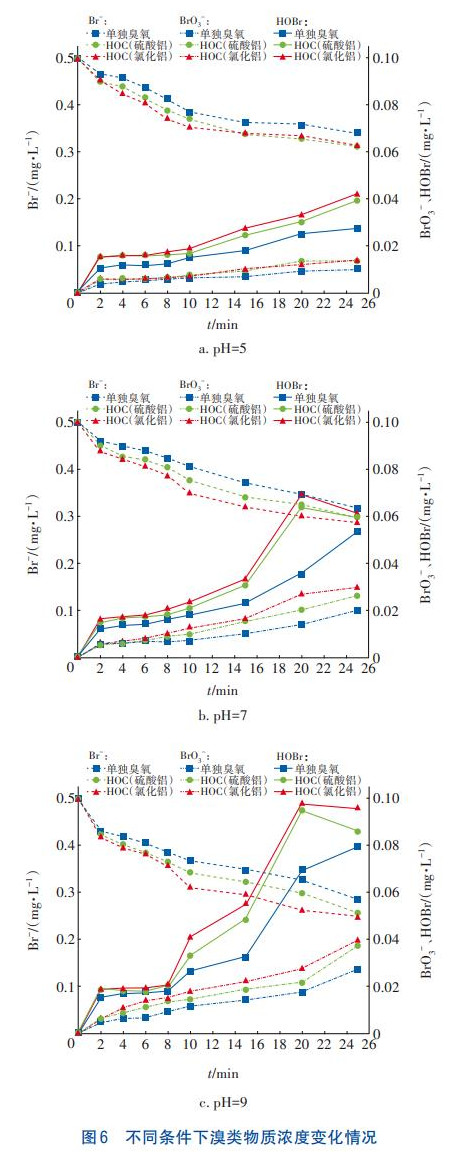
在HOC工藝處理二級出水過程中,通過測定Br的剩余量、BrO3-的生成量和中間產物HOBr/OBr-的生成量,分析其中的變化關系,研究BrO3-的生成途徑,結果如圖6所示。可知,隨著反應的進行,Br濃度逐漸降低;HOBr濃度在前8min左右較為穩定,在10~20min快速增加,到25min時略微降低;BrO3-濃度在前8min左右較低,后期緩慢增加。結合圖2中有機物去除率在8min時出現拐點,可以推測在HOC工藝反應前期,有機物通過與Br競爭氧化劑并與HOBr/OBr-反應生成有機溴化物,來有效控制中間產物HOBr/OBr-的濃度,從而阻塞BrO3-的生成路徑。由圖5可知,在pH=7和9條件下,HOC處理二級出水過程中BrO3-超標,通過圖6可以確定使BrO3-濃度滿足國家標準的HOC工藝允許反應時間,在pH=7條件下,HOC工藝(硫酸鋁)反應時間不超過10min、HOC工藝(氯化鋁)反應時間不超過8min;在pH=9條件下,HOC工藝(硫酸鋁)反應時間不超過6min、HOC工藝(氯化鋁)反應時間不超過4min。
2.3 HOC工藝中溴酸鹽生成的貢獻率
在HOC工藝中,Br通過臭氧直接氧化與羥基自由基間接氧化兩種途徑生成BrO3-消毒副產物,為此,在pH=7條件下研究兩種途徑對BrO3-生成的貢獻率。Elvoitz和vonGunten定義了一個臭氧氧化過程的參數Rct,如式(1)所示,它表示某時間段內·OH暴露量(dt)與O3暴露量(dt)的比值,Rct可通過式(2)計算。通過分析臭氧自分解反應一級動力學方程,并以p-CBA作為探針物質測定·OH的生成量,可以計算得到HOC體系反應過程中的Rct值,結果如圖7(a)和(c)所示。可知,Rct的數量級為10-9~10-8,在反應過程中,Rct先迅速下降而后逐漸趨于穩定,與Elovitz等人的研究結果類似。Rct可量化臭氧氧化過程中·OH的貢獻,計算HOC工藝中臭氧氧化和·OH氧化對BrO3-生成的貢獻率f(O3)和f(·OH)。Br-被·OH氧化的百分比(fBr-,·OH)可由式(3)計算,Br被臭氧氧化的百分比fBr-,O3=1-fBr-,·OH。根據vonGunten等的研究可以得到kBr-,•OH和kBr-,O3的值,將Rct·代入到中,得到式(4),據此可以計算得到fBr-,·OH。純水和二級出水體系中·OH和O3對溴酸鹽生成的貢獻率計算結果如圖7(b)和(d)所示。

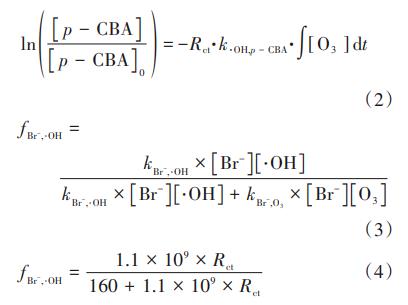
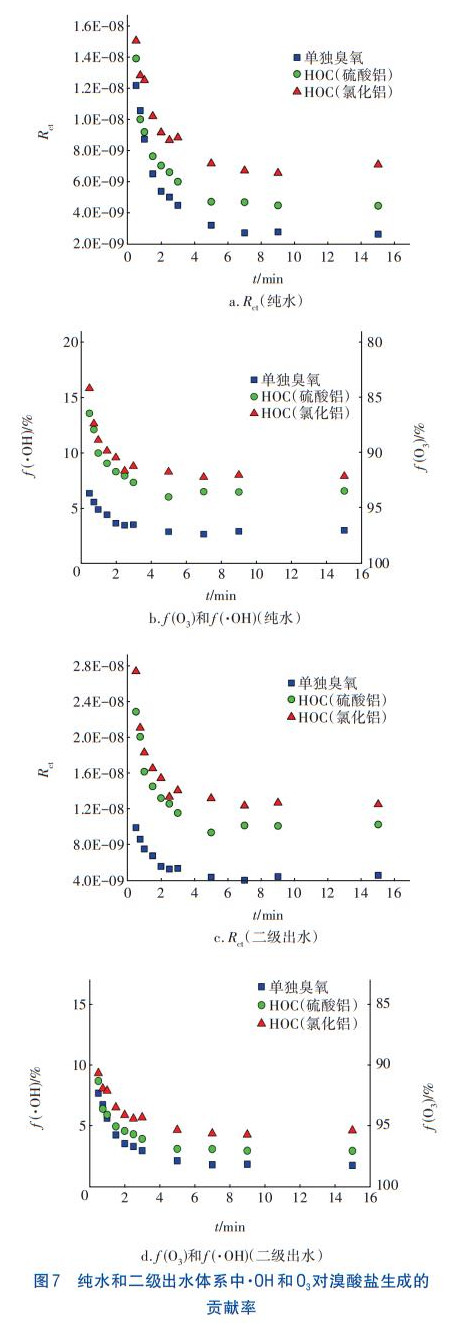
由圖7可知,HOC工藝的(·fOH)大于單獨臭氧氧化工藝,這是因為HOC工藝中p-CBA的去除率更高,即·OH的生成量更多。在反應初始階段,HOC工藝的(fO3)均在80%以上,這與O3暴露濃度較高有關,且(fO3)隨著氧化時間的延長而逐漸增大直至保持穩定,這與Qi等人的研究結果類似。通過對比可知,二級出水體系的(fO3)普遍比純水體系的高,這可能是由于有機物的存在增加了O3的消耗,提高了Rct值。當HOC工藝處理二級出水5min時,(fO3)達到95%以上,說明在Br的后半段氧化反應中,O3起到至關重要的作用,比如,O3與HOBr/OBr-反應生成BrO3-。因此,在HOC工藝中,臭氧直接氧化比·OH間接氧化對BrO3-的生成有更為重要的作用。
3、結論
①HOC工藝對二級出水中的有機物去除效果較好,然而BrO3-消毒副產物的生成會導致水體的急性毒性增強。在HOC工藝中,pH與臭氧投加量的增加會促進臭氧分解生成·OH,從而導致BrO3-生成量的增加,而二級出水中的有機物對BrO3-的生成具有明顯抑制作用。
②HOC工藝處理二級出水的最優條件如下:pH=7、臭氧投加量為1.0mg/mg、混凝劑采用氯化鋁且投加量為15mg/L(以Al計)、反應時間為8min,在此條件下有機物去除率在30%以上,且BrO3-生成量滿足《生活飲用水衛生標準》(GB5749—2006)的要求。
③在HOC工藝處理二級出水過程中,臭氧氧化是BrO3-生成的主要途徑,臭氧氧化的貢獻率隨著反應的進行先快速升高然后保持穩定,且均在90%以上。(來源:西安建筑科技大學環境與市政工程學院,成都市市政工程設計研究院有限公司,西安交通大學人居環境與建筑工程學院)



