氮素污染是我國水環境的主要污染之一,全程自養脫氮(CANON)工藝的出現為污水生物脫氮提供了新思路。該工藝在微氧條件下運行,一方面好氧氨氧化菌(AOB)將氨氮氧化成亞硝態氮,同時,厭氧氨氧化菌(AnAOB)將剩余的氨氮和生成的亞硝態氮轉化為氮氣。與傳統的硝化反硝化工藝相比,CANON工藝具有節省有機碳源、減少污泥產量、降低耗氧量和耗堿量、無二次污染等優點。然而,AnAOB生長速度緩慢,容易受到溫度、進水基質、pH等的影響。實際廢水中含有的重金屬、難降解有機化合物、病原菌等物質也可能會影響AnAOB活性。
目前,全球已有200多座自養脫氮工藝設施投入使用,當處理的污(廢)水中含有有毒物質時,或者遭遇工廠周期性運行、設備維修、自然災害以及不可抵擋的外來阻力而導致的長期停產時,污泥的理化性質以及微生物活性會受到嚴重的影響,如何快速恢復CANON工藝的脫氮性能是其大規模應用所必須要解決的問題。
CANON工藝在處理高氨氮廢水方面展現出極大的應用潛力。然而,實際廢水成分復雜,含有多種有毒物質,尤其是重金屬離子在各種廢水中被頻繁檢出,例如,在污水處理廠檢測到2.0μg/L的總汞,在工業廢水中檢測到30mg/L的Hg(Ⅱ)。Hg(Ⅱ)對微生物有強烈的毒害作用,抗汞細菌也只能耐受10mg/L的Hg(Ⅱ)。已有研究表明,Hg(Ⅱ)濃度達到20mg/L時,可使厭氧氨氧化系統的總氮去除率下降至55%,相關基因最大可改變468.8倍。然而,關于Hg(Ⅱ)是否對CANON系統存在持久性的影響,尤其是對其恢復能力的潛在影響目前尚未可知。而這對于污水廠接種CANON種泥的選擇、長期斷流后工藝恢復措施的設置等至關重要。
筆者以突發狀況下被迫停產的2個自養脫氮工藝運行的膜生物反應器(MBR)為研究對象,探究了長期斷流后CANON工藝的恢復特性,主要包括脫氮性能、運行特征以及微生物群落結構的變化,考察了Hg(Ⅱ)長期暴露對斷流后CANON工藝恢復特性的影響,以期為實際工程中CANON工藝的恢復提供參考。
1、材料與方法
1.1 實驗裝置與方法
實驗裝置如圖1所示,采用2個完全相同的MBR,分別標記為R1與R2。反應器由雙層有機玻璃制成,高為70cm,內徑為10cm,有效體積為4.5L,內置中空纖維膜,膜絲有效面積為0.1m2,膜孔徑為0.1μm,底部安裝曝氣環進行曝氣。在反應器上部安裝轉子流量計和壓力表,分別用來控制溶解氧(DO)濃度和監測膜污染程度,當壓力表示數達到-30kPa時清洗膜組件。進水和出水由蠕動泵控制,反應器內溫度為(25±3)℃。
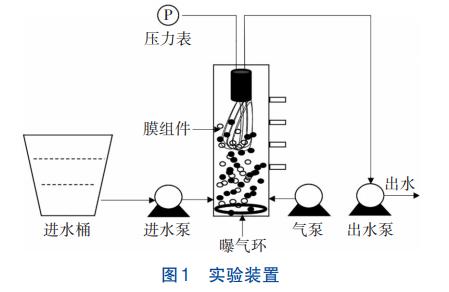
在長期斷流階段,R1和R2反應器在室內放置了5個月,溫度為(10±5)℃。其中,R2在長期斷流前曾經在Hg(Ⅱ)下長期暴露。長期斷流后,通過調整2個反應器的運行參數進行CANON工藝的恢復,具體運行條件如表1所示。

1.2 實驗用水
實驗用水為人工配制的模擬廢水,具體成分包括200mg/L的NH4+-N、1600mg/L的堿度(由NaHCO3提供)、68mg/L的CaCl2、68mg/L的KH2PO4、150mg/L的MgSO4、1mL/L的微量元素溶液Ⅰ和Ⅱ。其中,微量元素溶液Ⅰ的組分為:5000mg/L的EDTA、5000mg/L的FeSO4,微量元素溶液Ⅱ的組分為:15000mg/L的EDTA、430mg/L的ZnSO4·7H2O、240mg/L的CoCl2·6H2O、990mg/L的MnCl2·4H2O、250mg/L的CuSO4·5H2O、220mg/L的Na2MoO4·2H2O、190mg/L的NiCl2·6H2O、210mg/L的Na2SeO4·10H2O。所有實驗藥品均購自阿拉丁試劑有限公司。
1.3 分析項目與方法
NH4+-N采用納氏試劑分光光度法測定,NO2--N采用N-(1-萘基)-乙二胺分光光度法測定,NO3--N采用紫外分光光度法測定,pH、DO和溫度采用WTW多參數測定儀測定。總氮以氨氮、亞硝態氮和硝態氮之和計算。另外,采集2個反應器長期斷流前最后一天、恢復前最后一天以及恢復階段第52天的活性污泥樣品,送至上海生工生物工程有限公司,采用16SrRNA高通量測序技術檢測微生物群落結構。
2、結果與討論
2.1 未經Hg(Ⅱ)暴露反應器斷流后的恢復性能
R1反應器恢復過程的運行效果如圖2所示。在第Ⅰ階段(1~8d),水力停留時間(HRT)為6h,進水氨氮平均濃度為195.1mg/L,控制曝氣量為0.1L/min,DO平均濃度為0.1mg/L。第1~3天,氨氮去除率平均值為47.4%,這說明經過長期饑餓后AOB仍有一部分活性,可能是由于長期斷流期間缺乏營養基質,導致部分微生物死亡分解為氨氮,為AOB提供了基質。何麗金等將室溫儲存161d的厭氧氨氧化污泥進行活性恢復,初始氨氮去除率為75.3%,與本研究結果一致。TN去除率和TN去除負荷分別為-24.7%、-0.201kg/(m3·d),可能是運行初期HRT較短,活性較差的微生物被淘汰,死亡的微生物溶解在反應器中分解產生了氨氮,導致出水TN濃度高于進水。接著運行5d,出水氨氮濃度逐漸增加,氨氮去除率下降至17.4%,可能是長期無基質供給導致AOB表現出不穩定性。亞硝態氮積累率為(91.3±5.2)%,這說明亞硝酸鹽氧化菌(NOB)在斷流期間因缺乏基質已被淘汰,恢復初期系統內起作用的菌屬主要是AOB。在第Ⅱ階段(9~17d),保持曝氣量不變,延長HRT至8h,使微生物與氮素充分接觸,與第Ⅰ階段末期相比,出水氨氮濃度最高下降了39.0mg/L,但氨氮去除率、亞硝態氮積累率與TN去除率平均值無明顯差異。

在第Ⅲ階段(18~38d),仍保持曝氣量不變,繼續延長HRT至12h,氨氮與TN去除率分別為(41.2±19.1)%、(25.7±18.9)%,亞硝態氮積累率下降至50.4%,出水檢測到少量硝態氮。推測可能是AnAOB有初步恢復的跡象,使得部分總氮被去除,但出水氨氮濃度仍較高。為有效恢復AOB與AnAOB的活性,在第Ⅳ階段(39~55d),將曝氣量提高至0.2L/min,其他運行條件保持不變,DO平均濃度仍為0.1mg/L,說明第Ⅲ階段的曝氣量不足以供給好氧微生物呼吸。此階段出水氨氮濃度立即下降,氨氮和TN去除率以及TN去除負荷逐漸增加,同時也伴隨著硝態氮的產生。第41天,出水氨氮、亞硝態氮和硝態氮濃度分別為24.2、22.5、15.8mg/L,TN去除率和去除負荷分別為70.6%、0.300kg/(m3·d),ΔNO3--N/ΔNH4+-N為0.08,與理論值接近,認為R1反應器的CANON工藝成功恢復。繼續運行14d,TN去除率和去除負荷分別為(68.8±10.8)%、(0.273±0.043)kg/(m3·d),ΔNO3--N/ΔNH4+-N穩定在0.10。R1反應器采用提高HRT和曝氣量的方式,經過55d的運行,成功恢復CANON工藝并實現高效穩定運行。
2.2 Hg(Ⅱ)暴露反應器斷流后的恢復性能
R2反應器恢復過程的運行效果如圖3所示。第Ⅰ階段(1~3d)的運行條件與R1相同,采用6h的HRT和0.1L/min的曝氣量,反應器內DO平均濃度為0.6mg/L,而R1僅為0.1mg/L,說明R2的活性污泥消耗氧氣少,好氧微生物活性差。進水氨氮平均濃度為186.3mg/L,出水氨氮和亞硝態氮平均濃度分別為134.7、45.8mg/L,氨氮去除率平均值為27.7%,這說明經過長期饑餓后AOB仍保留了一部分活性,將部分氨氮氧化為亞硝態氮。相同條件下,R1的氨氮去除率為47.4%,說明R1中AOB的活性高于R2,這與反應器內DO濃度的差異一致。出水硝態氮平均濃度為2.2mg/L,TN去除率和去除負荷平均值分別為3.6%、0.027kg/(m3·d),說明AnAOB未表現出活性,活性污泥在斷流前Hg(Ⅱ)暴露及長期饑餓的雙重作用下,AnAOB活性受到嚴重的持久性抑制。亞硝態氮積累率平均值為96.1%,說明NOB已在系統中被抑制或者淘洗,在長期饑餓后系統內起脫氮作用的菌群主要是AOB,與R1相同。Chen等的研究表明,厭氧氨氧化系統能夠完全抵抗低濃度Hg(Ⅱ)(≤10mg/L)的暴露,當Hg(Ⅱ)濃度達到20mg/L時,表現出顯著的抑制作用,由此說明本研究中Hg(Ⅱ)的暴露對長期饑餓后厭氧氨氧化污泥活性的恢復具有不利影響。

在第Ⅱ階段(4~24d),將HRT提高至12h,基于AnAOB不能承受太高濃度的DO,將曝氣量調整為0.075L/min,DO隨之降為0.2mg/L。出水氨氮濃度緩慢降低,出水亞硝態氮濃度逐漸增加,第22~24天,氨氮去除率平均值為86.4%,說明AOB活性得到了恢復;TN去除率平均值為9.8%,說明AnAOB仍未表現出活性;亞硝態氮積累率平均值為92.6%,說明該系統的反應只進行到了短程硝化階段。研究表明,AnAOB的細胞密度>1010個/mL時才能顯現出活性,推測可能是AnAOB的細胞密度較低而未表現出活性。CANON工藝需要AOB與AnAOB的協同合作完成脫氮過程,此階段AOB活性已得到恢復。
在第Ⅲ階段(25~52d),保持HRT為12h,繼續減小曝氣量至0.05L/min,為AnAOB提供厭氧環境,DO平均濃度隨之降為0.1mg/L,出水氨氮濃度立即增加,氨氮去除率平均值為60.9%,說明降低DO濃度限制了AOB活性。TN去除率平均值為17.2%,說明AnAOB始終未表現出活性。經過52d的運行,通過降低進水氮負荷和DO濃度的方法進行CANON工藝的恢復,TN去除率始終低于30%,TN去除負荷穩定在0.105kg/(m3·d)以下,氨氮去除率和亞硝態氮積累率平均值分別為60.9%、92.3%,整個系統已由斷流前的CANON工藝轉變為短程硝化工藝。此外,在恢復階段第1天的出水中檢測到6.0μg/L的Hg(Ⅱ),說明Hg(Ⅱ)具有較強的累積毒性,這是因為重金屬不具有代謝的特性,其在微生物細胞內難以排出或緩慢排出。Bi等通過批量實驗研究Hg(Ⅱ)對厭氧氨氧化的短期影響,發現Hg(Ⅱ)對厭氧氨氧化活性污泥具有持續的毒性,這進一步說明Hg(Ⅱ)的累積毒性抑制了AnAOB活性的恢復。
2.3 運行性能與微生物特征的對比
為進一步分析2個反應器的恢復性能,采用高通量測序技術檢測在長期斷流前最后一天、恢復前最后一天與恢復階段第52天的微生物群落結構變化,結果如圖4所示。

由圖4可知,2個反應器在不同階段的AnAOB均為Candidatus_Kuenenia,在斷流前的相對豐度分別為16.0%、10.3%,恢復前的相對豐度分別為9.4%、10.8%,長期饑餓后R2中AnAOB的相對豐度無明顯變化,可能是由于斷流前AnAOB在核糖體內儲存能量,在斷流期間將其用作能量,R1與R2在恢復初期(1~3d)的TN去除負荷分別為-0.201、0.027kg/(m3·d),雖然AnAOB的相對豐度變化不大,但其經過長期饑餓后活性較低。恢復階段第52天,2個反應器中AnAOB的相對豐度分別為4.8%、8.4%,TN去除負荷分別為0.294、0.102kg/(m3·d),AnAOB的相對豐度與TN去除負荷呈負相關,分析其原因:①R1中的優勢菌是AnAOB,而R2中則為反硝化菌(27.8%)和AOB(11.9%);②R1中檢測到的未分類微生物較多,相對豐度達到37.4%,而在R2中僅為9.5%;③R2中Hg(Ⅱ)的累積毒性抑制了AnAOB活性。
2個反應器中的AOB均為Nitrosomonas,在斷流前的相對豐度分別為0.6%、0.5%,恢復前的相對豐度分別為21.0%、0.5%,恢復初期氨氮去除率分別為47.4%、27.7%,AOB的相對豐度與氨氮去除率一致;在恢復階段第52天,R1與R2中AOB的相對豐度分別為4.8%、11.9%,氨氮去除率分別為93.2%、58.9%。一方面,AOB的相對豐度與氨氮去除率呈負相關,出現這一現象的原因與AnAOB一致,因此,R1中有一部分氨氮去除率是AnAOB完成的;另一方面,R1中AOB的相對豐度在恢復前增加,恢復后減小,也可能是AOB更容易恢復活性,AnAOB在后期恢復活性后,開始消耗氨氮,AOB因此減少。2個反應器中微生物群落的對比結果表明,Hg(Ⅱ)的積累沒有直接將AOB與AnAOB滅活,而是抑制了其脫氮活性。
2個反應器中的反硝化菌主要為Truepera、Xanthomonadaceae、Ignavibacterium。Xanthomonadaceae屬于變形菌門,有研究認為其在SBR中具有反硝化作用。Truepera對環境具有高抵抗性。陳彥霖等認為Ignavibacterium屬于厭氧異養菌,可能具有反硝化或異化硝酸鹽還原功能。在斷流前,R1中Xanthomonadaceae、Truepera、Ignavibacterium的相對豐度分別為17.2%、5.0%、6.1%,R2中為19.6%、4.4%、6.6%,2個反應器中反硝化菌的相對豐度無明顯差異;恢復前,R1中Xanthomonadaceae、Truepera、Ignavibacterium的相對豐度分別為11.3%、2.8%、0,R2中為31.8%、6.0%、7.0%,R2中反硝化菌的相對豐度增加,可能是在長期斷流期間部分微生物由于缺乏基質逐漸死亡,反硝化菌利用菌體死亡裂解產生的有機物而生存;恢復階段第52天,R1中Xanthomonadaceae、Truepera、Ignavibacterium的相對豐度分別為2.7%、1.4%、0,R2中為21.4%、4.6%、1.8%,說明R1的主要脫氮微生物是AOB與AnAOB,而R2則為AOB和反硝化菌,但R2并未表現出脫氮性能,可能是恢復階段反硝化菌可利用的有機碳源較少,而且反硝化菌總相對豐度的下降也證明其因缺乏基質而死亡。因此,R2中的反硝化菌在恢復階段沒有起到脫氮作用。
2.4 Hg(Ⅱ)暴露影響工藝恢復的機理
2個反應器經過長期饑餓后,恢復初期的脫氮性能均較差。R1能夠成功恢復CANON工藝并穩定運行的主要原因是:①適當延長HRT。彭永臻等研究發現,在較低的氮負荷下,微生物可以分泌更多的胞外聚合物,而且降低氮負荷減小了對微生物的沖擊,更有利于系統脫氮功能菌的恢復。Chen等研究發現,HRT從24~48h下降到12h,TN去除率從90%下降到80%。在本研究中,R1的HRT從第Ⅰ階段的6h逐漸增加至第Ⅲ階段的12h,TN去除率從-24.7%增加至(25.7±18.9)%,AnAOB有初步恢復的跡象。這充分說明適當延長HRT有利于微生物與基質充分接觸,進一步促進微生物的生長。②適當調整曝氣量,將反應器內DO濃度控制在0.1mg/L,為AOB與AnAOB提供適宜的生存環境,同時有效抑制了NOB的活性。李亞峰等采用UASB反應器研究HRT、DO和有機物對厭氧氨氧化脫氮性能的影響,發現HRT和DO的影響較大,有機物的影響較小,同時DO較高時,雖然反應受到影響,但隨之降低DO,脫氮性能可逐漸恢復。在本研究中,R1的曝氣量從第Ⅲ階段的0.1L/min增加至第Ⅳ階段的0.2L/min,TN去除率由(25.7±18.9)%增加至(68.8±10.8)%,這說明有效調控DO濃度是CANON工藝恢復的關鍵。因此,經過長期斷流的自養脫氮污泥,可以采用提高HRT、降低氮負荷以及調控DO的方式進行微生物活性的恢復。
R1與R2在恢復前的運行條件完全相同,恢復期間的反應器形式、進水基質及濃度也相同,而R2采用同樣的方式卻沒有成功恢復CANON工藝,主要原因是:R2在長期斷流前曾經在Hg(Ⅱ)下長期暴露,再經過長達5個月的室溫靜置后導致AnAOB的活性難以恢復。有研究通過批量實驗發現,Hg(Ⅱ)的半抑制濃度(IC50)為2.3mg/L,厭氧氨氧化活性污泥具有較高的重金屬累積能力,這也是活性被抑制的關鍵原因,同時活性污泥和胞外聚合物所具有的官能團可能有助于重金屬的吸附。此外,在Hg(Ⅱ)暴露下,肼脫氫酶活性和血紅素C濃度也降低,這說明Hg(Ⅱ)容易吸附在微生物細胞內。有研究評估了銅、鎘和汞在不同劑量單獨或聯合添加對微生物群落結構的短期影響,結果表明,金屬毒性存在累積效應。Pei等研究表明,Hg的累積能力很強,可以使微生物群落結構發生改變。在開始恢復的第1天R2出水中也檢測到了微量的Hg(Ⅱ),Hg(Ⅱ)在微生物細胞內長期存在,抑制了AnAOB活性,導致其難以恢復。在恢復階段的第52天,R2中的優勢菌屬是AOB和反硝化菌,也進一步證明了Hg(Ⅱ)對AnAOB的持久抑制性。此外,R2的氨氮去除率和亞硝態氮積累率平均值分別為60.9%、92.3%,整個系統已由斷流前的CANON工藝轉變為短程硝化工藝。在實際應用中,一方面,由于NOB難以被抑制,導致短程硝化工藝很難實現,R2的污泥可以直接作為短程硝化的種泥來源,解決短程硝化工藝啟動難的問題;另一方面,R2的污泥可以與厭氧氨氧化反應器串聯,成為兩級式的短程硝化-厭氧氨氧化工藝,但不能單獨作為厭氧氨氧化污泥發揮脫氮作用。
3、結論
①未經Hg(Ⅱ)暴露的R1在長期斷流后,經過55d的運行,TN去除率恢復至(68.8±10.8)%;而經過Hg(Ⅱ)長期暴露的R2,TN去除率始終低于30%,亞硝態氮積累率達到(93.5±6.5)%,CANON工藝轉變為短程硝化工藝。Hg(Ⅱ)在微生物細胞內難以排出而長期積累,使AnAOB受到了Hg(Ⅱ)的持久性抑制,從而導致CANON工藝未成功恢復。
②高通量測序結果表明,R1中AnAOB和AOB的相對豐度在斷流前分別為16.0%、0.6%,恢復前為9.4%、21.0%,恢復后為4.8%、4.8%;而在R2中,長期斷流前分別為10.3%、0.5%,恢復前為10.8%、0.5%,恢復后為8.4%、11.9%。
③經過長期斷流的自養脫氮污泥,可以采用提高HRT、降低氮負荷以及調控DO的方式進行微生物活性的恢復;經過Hg(Ⅱ)長期暴露后,再經過長期斷流的自養脫氮污泥可以作為短程硝化的種泥來源,與厭氧氨氧化反應器串聯發揮脫氮作用。(來源:鄭州輕工業大學材料與化學工程學院環境污染治理與生態修復河南省協同創新中心)



