隨著我國城市污水處理能力的提升, 伴生的剩余污泥產量逐年增加, 厭氧消化是實現污泥資源化的重要技術.城市污泥處置方式主要有衛生填埋、焚燒、土地利用和建材利用等, 其中土地利用是城市污泥處置的重要途徑, 城市污泥富含氮、磷和有機質等營養成分, 施用污泥可增加土壤養分, 對土壤具有改良作用.近年來, 我國發布的《水污染防治行動計劃》提出加快推進污泥的資源化利用, 因此, 城市污泥經厭氧消化處理后進行土地利用是我國污泥處置與資源化的重要途徑, 但城市污泥中重金屬、病原菌及有機污染物是限制污泥土地利用的重要因素.汞(Hg)作為一種具有高毒性、持久性和生物累積性的重金屬是污泥土地利用(農用、園林綠化、土壤改良)的重要控制元素.已有研究報道了我國污泥中汞含量存在不同程度的超標現象, 根據土壤性質和農作物種類, 往往介于酸性土壤不可用(A級污泥)與中性、堿性土壤可用(B級污泥)的程度.有研究表明, 污泥土地利用會增加土壤汞含量, 并且汞在植物體內富集.同時, 汞轉化生成的甲基汞(MeHg)是對人體極其有害的高毒性、脂溶性物質, 可在生物體內累積, 可對人類健康造成嚴重危害.Mao等的研究表明, 我國城市污水處理廠中約80%以上的汞轉移到剩余污泥.所以, 汞在污泥后續處理處置過程的遷移轉化, 特別是土地利用中的潛在健康風險不容忽視, 然而, 這方面研究仍然缺乏.
在污泥處理處置過程中, 厭氧消化過程可能是汞發生甲基化和去甲基化的重要環節.有研究表明, 厭氧環境下, 硫酸鹽還原菌(sulfate-reducing bacteria, SRB)在汞的甲基化過程中發揮重要作用, 而產甲烷菌(methanogens)和鐵還原菌(iron-reducing bacteria, FeRB)也被證實是主要的汞甲基化微生物, 其中產甲烷菌、硫酸鹽還原菌為厭氧消化過程優勢微生物.污泥厭氧消化過程中豐富的有機物、功能微生物可能為汞的甲基化/去甲基化提供條件.此外, 含硫化合物影響汞的甲基化過程, 硫化物抑制汞的甲基化, 硫酸鹽對土壤和沉積物中汞的甲基化過程具有促進作用.污泥由于含有較高濃度的蛋白質類有機物, 往往隨蛋白質分解會釋放大量的硫化物, 同時在污泥高級厭氧消化工藝過程中, 熱水解過程大量稀釋水的加入也容易引入一定硫酸鹽.硫化物/硫酸鹽可能是污泥厭氧消化過程中汞形態遷移轉化的重要影響因素.
綜上所述, 本研究以基于高溫熱水解的污泥高級厭氧消化為研究對象, 考察甲基汞在污泥厭氧消化不同階段的變化情況, 通過質量衡算分析厭氧消化過程汞甲基化/去甲基化的發生情況, 研究硫酸鹽對污泥汞甲基化的影響, 以期為揭示汞在污泥厭氧消化中遷移轉化和污染控制提供理論依據.
1 材料與方法
1.1 實驗材料
實驗所采用的熱水解污泥和厭氧消化接種污泥分別取自北京市某污水處理廠高溫熱水解(165℃, 6×105 Pa)單元和中溫厭氧消化(37~40℃)反應器, 該污水處理廠采用Cambi熱水解預處理強化剩余污泥產甲烷, 設計處理能力1 840 t ·d-1(以含水率80%計).污泥取回后置于4℃冷庫保存待用, 熱水解污泥和接種污泥基本特性如表 1所示.

表 1 熱水解污泥、接種污泥基本理化特征
1.2 實驗方法
本實驗裝置采用全自動甲烷潛勢(Biochemical methane potential, BMP)測試系統(AMPTS Ⅱ, Bioprocess Control, 瑞典), 水浴鍋控制厭氧消化溫度(37±0.5)℃.為模擬投加硫酸鹽后污泥中汞的遷移轉化情況, 本實驗未向污泥中投加汞源, 以污泥中原有汞作為汞源.實驗設置了4個硫酸鹽投加梯度和一個空白對照, 無水硫酸鈉的投加量(以TS計)分別為50、100、200和400 mg ·kg-1, 空白對照組未投加無水硫酸鈉.厭氧消化單元由15個配置全自動內置攪拌系統的反應瓶構成, 有效體積為1.4 L, 反應前通氮氣3 min排除體系內空氣, 接種污泥與剩余污泥的接種(VS接種污泥/VS熱水解污泥)比為1, 每組實驗設置3個平行.
1.3 分析方法與質量控制
采集的污泥樣品經冷凍干燥機(FD-1A-50, 北京博醫康儀器有限公司)于-50℃冷凍干燥后, 研磨并過100目篩, 置于4℃條件下保存待測.污泥中總汞(THg)采用固體測汞儀(Hydra Ⅱ, 美國利曼)測定.污泥甲基汞(MeHg)采用溶劑萃取-乙基化衍生-氣相色譜與冷原子熒光光譜聯用法(GC-CVAFS)測定.樣品分析過程中采用空白實驗、平行樣控制及標準物質測定進行質量控制.污泥總汞以沉積物標準物質GSS-27作為質控樣品, 其標定值為116 μg ·kg-1, 實際測定值為(108.80±2.49)μg ·kg-1(n=5), 回收率為93.79%.沉積物標準參考物質ERM-CC580中MeHg濃度為(75±4)μg ·kg-1, 實驗測得MeHg濃度為(70.99±7.19)μg ·kg-1(n=5), 測定回收率為94.65%.
污泥pH和電導率通過pH計(FE20K, Mettler Toledo)和電導率儀(Multi 3420)進行測定, TS和VS通過重量法測定; 污泥稀釋離心并經0.45 μm濾膜過濾后, 保留濾液用于常規理化指標測定.SCOD采用試劑盒(HACH, US)測定, 正磷酸鹽采用鉬銻抗分光光度法測定, 溶解性蛋白質和多糖分別采用修正的Frølund等和DuBois等報道的分光光度法測定, 總有機碳(TOC)采用總有機碳分析儀(TOC-L, Japan)測定, 污泥上清液中硫元素、鐵元素經消解后采用電感耦合等離子體發射光譜儀(ICP-OES, OPTIMA, 美國珀金埃爾默)測定, 揮發性脂肪酸(Volatile fatty acids, VFAs)由氣相色譜(Shimadzu, Japan)測定, 檢測器為火焰離子化檢測器(FID), 色譜柱為HP-FFAP毛細管柱(0.25 mm×25 m), 進樣口溫度為220℃, 檢測器溫度為250℃.
2 結果與討論
2.1 總汞
污泥厭氧消化不同時期總汞(THg)含量變化如圖 1所示, 初始污泥中總汞質量為(3.26±0.18)mg ·kg-1, 隨著厭氧消化進行, 污泥中總汞含量在逐漸增加.厭氧消化結束時, 空白組及硫酸鹽投加組(梯度由低到高)污泥中總汞質量分別為(4.87±0.04)、(4.40±0.36)、(4.32±0.02)、(4.20±0.28)和(4.52±0.26)mg ·kg-1, 低于文獻中報道的北京市剩余污泥總汞含量[(7.16±3.56) mg ·kg-1], 滿足我國園林綠化用泥質、土地改良用泥質中酸性土壤(pH<6.5)的限值要求(5 mg ·kg-1), 但超過我國污泥農用標準中關于A級污泥的限值要求(3 mg ·kg-1).污泥總汞含量增加主要是因為污泥有機物分解產甲烷后產生的濃縮效應.
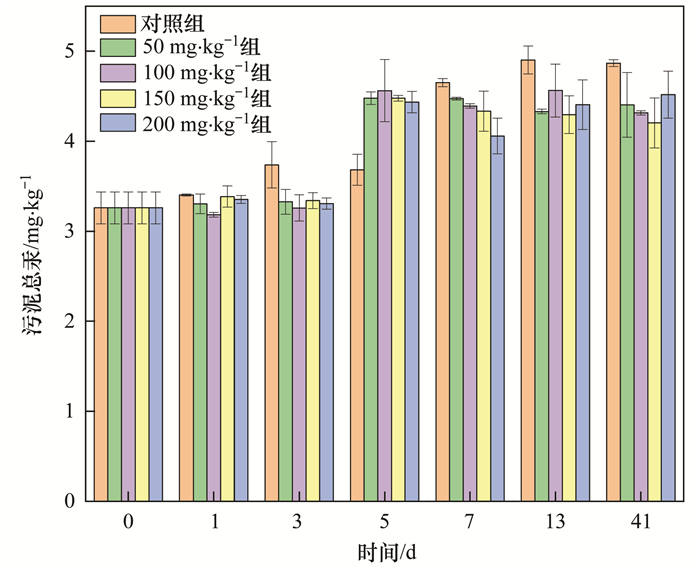
圖 1 污泥總汞含量變化
結合厭氧消化前后污泥濃度(TS)變化, 本研究對總汞進行質量衡算.厭氧消化初始時污泥TS為5.68%, 初始污泥量為1.4 kg, 經計算厭氧消化初始污泥中總汞質量為259.24 μg, 厭氧消化結束時實驗組污泥濃度分別為4.40%、4.71%、4.62%、4.65%和4.55%, 計算得到總汞質量分別為246.00、245.76、228.73、224.29和236.25 μg, 低于厭氧消化初始時刻.這一方面可能由于厭氧消化過程中樣品采集造成了總汞含量的損失, 另一方面, 在避光厭氧條件下, Hg2+在微生物和礦物質顆粒的作用下通過多種反應途徑還原生成氣態單質汞(Hg0), 跟隨甲烷氣體逸出, 造成污泥總汞含量的損失.
2.2 甲基汞
污泥厭氧消化過程中甲基汞含量變化如圖 2所示, 初始污泥中甲基汞含量為(0.494±0.05)μg ·kg-1, 厭氧消化結束時各實驗組污泥(干重)甲基汞含量分別為(0.69±0.05)、(0.88±0.14)、(0.67±0.05)、(0.98±0.12)和(0.80±0.10)μg ·kg-1, 甲基汞含量大幅增加, 這是由于厭氧消化過程污泥有機物消減, 甲基汞隨著濃縮效應而致含量增加, 因此, 從含量變化難以判斷汞甲基化的發生.

圖 2 污泥甲基汞含量變化
結合污泥濃度的變化, 計算厭氧消化不同階段污泥中甲基汞總量的凈增量(圖 3).厭氧消化的前3 d, 污泥中甲基汞總量增量及甲基汞含量(圖 2)呈現增加趨勢, 厭氧消化第3 d, 空白對照組的甲基汞總量增量甚至達到73.89 ng, 是初始污泥甲基汞總量的1.83倍, 投加硫酸鹽的實驗組污泥甲基汞總量也有不同程度的增加, 但低于空白對照組, 說明該階段污泥中發生了汞的甲基化作用, 并且硫酸鹽可能使汞甲基化進程受到了抑制.厭氧消化初始汞的甲基化可能與污泥中大量存在的有機物有關, 高溫熱水解過程使污泥中有機物降解釋放, 與此同時, 污泥中不易溶解的有機物和高分子化合物(如蛋白質和多糖等)被水解酶降解為可溶性小分子有機物(如氨基酸和脂肪酸等), 增加了汞甲基化微生物的營養物質, 使得微生物的活性增強, 從而有利于甲基化的發生.到第5 d時, 污泥甲基汞含量大幅度減小(圖 2), 污泥中甲基汞總量增量呈現負值(圖 3), 這期間發生了汞的去甲基化.厭氧條件下主要發生汞的氧化去甲基化, 這由硫酸鹽還原菌和產甲烷菌驅動, 將甲基汞氧化為Hg(Ⅱ)、CO2和少量甲烷.汞的去甲基化是微生物的一種解毒機制, 在厭氧消化的第3~5 d, 由于污泥總汞含量迅速增加(圖 1), 微生物受到汞的脅迫從而加快了汞的去甲基化進程.厭氧消化第7 d, 污泥中甲基汞總量大幅度增長, 第13 d時又呈現負增長.具體聯系污水寶或參見http://www.bnynw.com更多相關技術文檔。
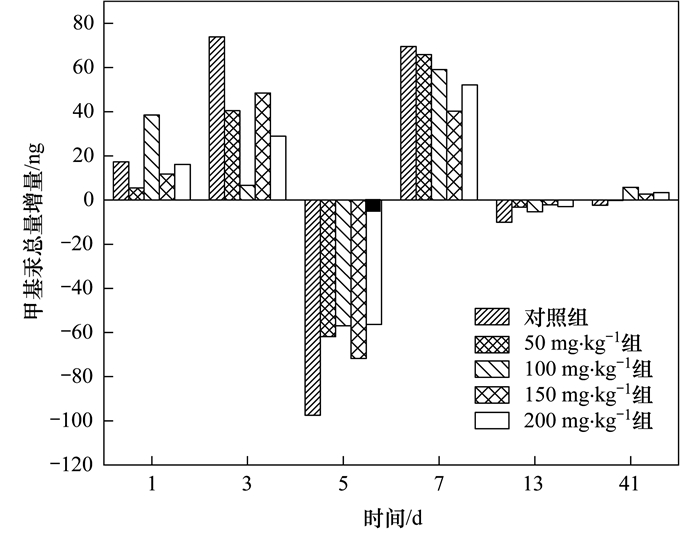
圖 3 厭氧消化不同階段污泥中甲基汞總量增量
如圖 4所示, 上清液中溶解態甲基汞(DMeHg)濃度與污泥中總甲基汞含量呈現基本相同的變化趨勢, 厭氧消化初始時污泥上清液中溶解態甲基汞的濃度為(15.00±1.11)ng ·L-1, 厭氧消化結束時各實驗組污泥上清液中溶解態甲基汞濃度分別為(79.93±8.22)、(48.52±4.04)、(59.61±3.21)、(66.12±5.30)和(62.14±1.00)ng ·L-1, 分別增加了426.67%、223.47%、297.4%、340.8%和314.27%.

圖 4 污泥上清液中溶解態甲基汞含量變化
甲基汞占總汞的比值(MeHg/THg)可間接反映汞的甲基化能力, 不同實驗組甲基汞占總汞的比例如圖 5所示, 比值范圍為0.006% ~0.048%, 相比于土壤和沉積物, 厭氧消化污泥中MeHg/THg比值較低, 可能與厭氧消化體系中活性汞含量較低, 大部分汞以殘渣態形式存在有關, 并且污泥中豐富的有機質可能對Hg2+具有絡合作用, 降低汞的生物有效性.污泥MeHg/THg比值與污泥中甲基汞總量衡算呈現出一致的結果, 在厭氧消化前3 d, 各實驗組污泥MeHg/THg比值隨反應的進行而增加, 達到最大值, 而在第5 d, MeHg/THg比值降低, 第7 d, MeHg/THg比值再次增加, 而后續的MeHg/THg比值變化較小.
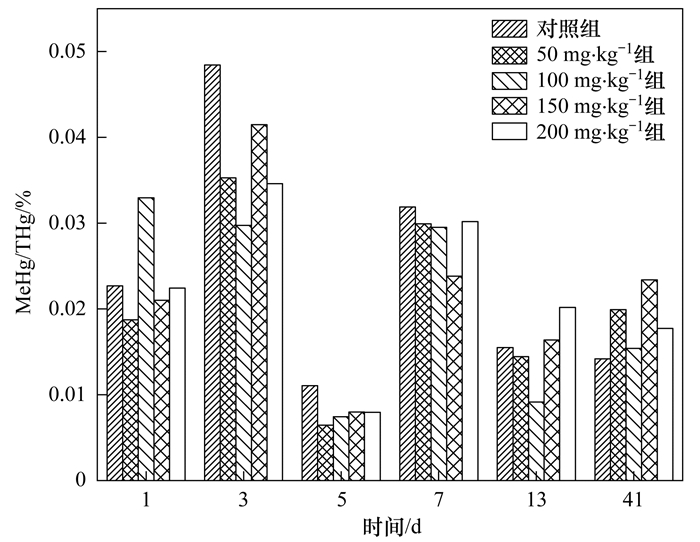
圖 5 厭氧消化不同階段污泥MeHg/THg變化
通過分析厭氧消化不同階段甲基汞含量變化、甲基汞總量增量變化及甲基汞占總汞的比值發現, 污泥厭氧消化過程中汞的形態發生了遷移轉化, 在前3 d和第5~7 d發生了汞的甲基化, 而在第3~5 d及第7~13 d, 汞發生了去甲基化過程, 這表明污泥厭氧消化過程是汞形態轉化的場所, 發生著汞甲基化和去甲基化的動態變化.
2.3 污泥中甲基汞含量與環境因素相關性分析
汞的甲基化過程受多種環境因素的影響, 包括pH、含硫化合物、微生物、Fe和有機質等.本研究通過冗余分析(redundancy analysis, RDA)考察污泥厭氧消化過程中汞形態變化與污泥常規理化參數的關系, 揭示厭氧消化過程中汞形態遷移轉化與環境因子間的關聯.本研究將污泥中總汞、甲基汞和溶解態甲基汞作為物種變量, 上清液Fe和pH等環境因子作為解釋變量, 結果如圖 6所示.厭氧消化不同階段污泥聚合在不同象限, 表明污泥總汞、甲基汞、溶解態甲基汞含量在厭氧消化不同階段存在顯著差異.污泥中甲基汞含量與丙酸、異丁酸、異戊酸、Fe和TOC正相關, 表明污泥中有機質、適量Fe可能對甲基化過程具有促進作用, 同時污泥汞甲基化還受到VFAs的影響, 這可能與VFAs為異養型硫酸鹽還原菌利用有關.污泥上清液中溶解態甲基汞與污泥中甲基汞總含量呈正相關, 而總汞含量與甲基汞含量呈現負相關, 這可能是由于厭氧消化系統中生物可利用汞的比例較低.蛋白質和pH值均與甲基汞含量呈負相關, 表明厭氧消化過程中蛋白質的變化和較高的pH值均可能是汞甲基化的制約因素.含硫蛋白質在發酵型細菌和產甲烷菌的作用下釋放出含硫氨基酸, 從而抑制了甲基化過程; 而pH對汞甲基化的影響相關研究表明, 酸性條件有利于甲基汞的形成, 堿性條件可能抑制汞的甲基化.厭氧消化不同階段各實驗組pH變化范圍為7.54~7.98(圖 7), 整個過程污泥pH為堿性, 并且在第5 d各組污泥pH達到最大值, 而甲基汞含量最低(圖 2), 凈增量為最大負值(圖 3); 第7 d時, 由于污泥中未被高溫熱水解過程降解的大分子有機物開始水解, VFAs發生了累積, 各實驗組總VFAs平均濃度(5 d)由(552.25±129.06)mg ·L-1升高至(1 168.97±414.12)mg ·L-1, 其中不同實驗組丙酸平均含量為第5 d的2.3~7.6倍, 例如, 第5 d不同實驗組丙酸均值為(104.26±3.23)mg ·L-1, 第7 d不同實驗組丙酸均值為(443.90±209.85)mg ·L-1, 異丁酸和異戊酸也有不同程度的增加, 污泥pH降低, 而污泥中甲基汞含量(圖 2)及甲基汞總量凈增量(圖 3)均增加.Mcfarland等的研究表明, 厭氧消化過程pH值從6.7升高到8.2時, 溶解性硫化物濃度隨之增加, 由18 mg ·L-1增加到61 mg ·L-1, 所以, 厭氧消化過程中較高的pH值是抑制汞甲基化的關鍵因素之一, 并且pH變化可能與溶解性硫化物的濃度密切相關.
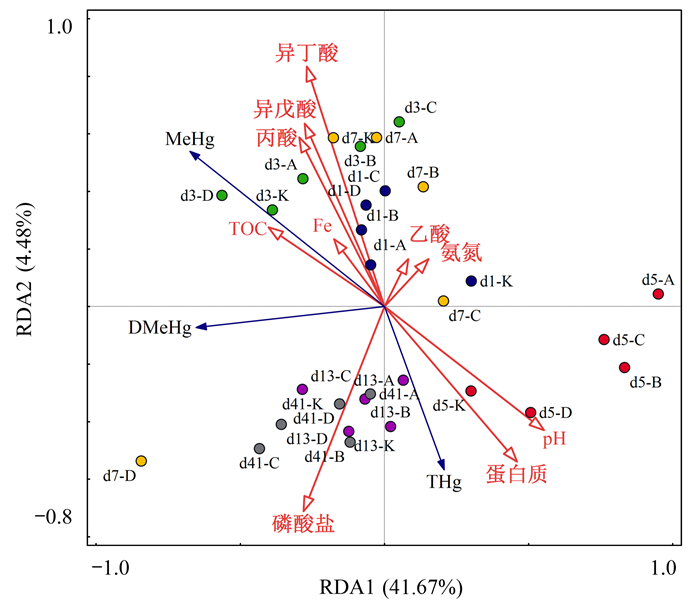
藍色箭頭為物種變量; 紅色箭頭為解釋變量; d代表厭氧消化時間, 不同顏色分別代表厭氧消化不同時間, K、A、B、C和D分別代表對照組及硫酸鹽投加量為50、100、150和200 mg ·kg-1的實驗組, 其中靛藍表示第1 d, 綠色表示第3 d, 紅色表示第5 d, 黃色表示第7 d, 紫色表示第13 d, 灰色表示第41 d
圖 6 污泥汞形態與環境因素的冗余分析

圖 7 厭氧消化不同階段污泥pH變化
2.4 污泥厭氧消化過程中硫的遷移轉化
厭氧條件下硫的轉化途徑有生物轉化和非生物轉化.生物轉化有兩種途徑:①硫酸鹽還原菌主導, 將硫酸鹽還原為硫化物; ②含硫蛋白質在厭氧發酵細菌和產甲烷菌的作用下降解為含硫氨基酸等.硫的非生物轉化是物理化學轉化, 一部分硫可通過與金屬離子(Fe2+、Hg2+)形成沉淀-溶解平衡進行, 另一部分遵循硫化氫的解離和溶解平衡規律.硫酸鹽還原菌的代謝過程不僅與硫的遷移轉化相關, 同時也與汞的甲基化途徑有關.硫酸鹽可提高硫酸鹽還原菌的活性, 但同時也產生代謝產物硫化物.有研究表明, 硫酸鹽對汞的甲基化具有促進作用, 而本研究中, 硫酸鹽投加濃度梯度的變化對汞甲基化的促進作用并不明顯(P=0.93>0.05).通過對污泥上清液中S元素濃度測定發現(圖 8), 厭氧消化前3 d, 污泥上清液中硫元素濃度呈梯度變化, 高硫酸鹽投加組, 硫化物濃度較高, 隨反應的進行HgS0逐漸被生物可利用性較低的二硫配合物HgHS2-和HgS22-所取代, 體系中甲基汞也可與硫化氫反應生成可揮發性二甲基汞, 抑制甲基汞的產生, 這可能是厭氧消化初期, 硫酸鹽投加反而導致甲基汞增量低于空白對照組的原因.此后, 各實驗組上清液中S元素濃度差別較小, 分析可能是投加的硫酸鹽在硫酸鹽還原菌的作用下還原為S2-, 而S2-又與污泥中的Fe2+和Hg2+等金屬離子形成沉淀, 通過吸附和協同作用固定金屬離子, 降低游離S2-濃度間接抑制硫的遷移轉化.由表 2可知, 污泥常見含硫電解質溶度積常數(Ksp)由大到小順序為: FeS>β-ZnS>α-ZnS>CdS>PbS>CuS>HgS(黑色)>HgS(紅色), 硫酸鹽還原產物S2-可降低生物利用的溶解態汞含量, 一方面硫酸鹽的投加在厭氧消化前期抑制汞的甲基化, 另一方面厭氧消化后期不同實驗組硫酸鹽濃度均衡, 難以進一步影響汞的甲基化.
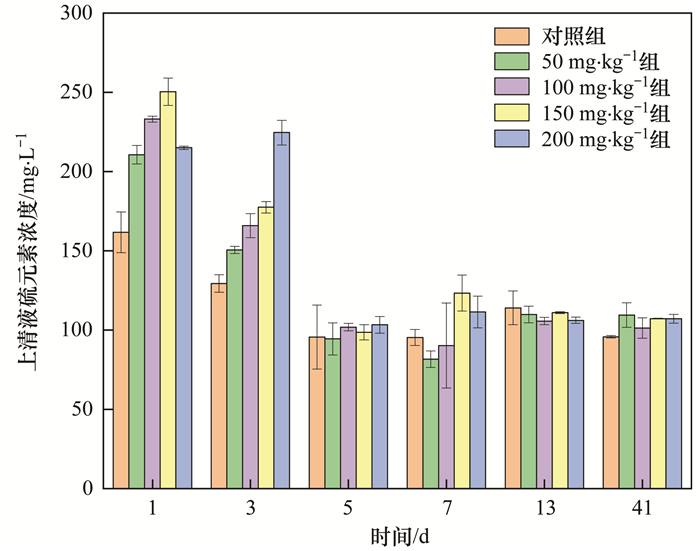
圖 8 上清液硫元素含量變化
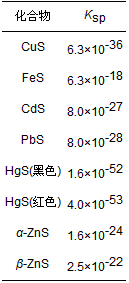
表 2 含硫難溶電解質溶度積常數
3 結論
(1) 基于熱水解的污泥厭氧消化過程發生了汞的甲基化和去甲基化, 該過程主要發生在厭氧消化前期, 這可能與厭氧消化初期污泥中大量存在的有機物有關; 厭氧消化過程中污泥MeHg/THg比值較低, 這與污泥中大量存在的殘渣態汞密切相關.
(2) RDA分析結果表明, 污泥厭氧消化過程中汞的甲基化受多種環境因素的影響, 其中適量Fe的存在、有機質以及揮發性脂肪酸可能對汞的甲基化具有促進作用, 而蛋白質、較高的pH值可能是該過程中汞甲基化的抑制因素.
(3) 硫酸鹽的投加導致厭氧消化前期汞甲基化受到一定抑制, 后期影響較小.厭氧消化初期, 硫酸鹽還原為S2-, 高硫酸鹽投加組硫化物濃度較高, 易與Hg2+生成沉淀, 降低汞的生物有效性; 厭氧消化后期, 由于S2-易與污泥中的金屬離子形成難溶沉淀, 抑制了硫的遷移轉化, 難以繼續影響汞的甲基化.(來源:天津工業大學環境科學與工程學院 作者:何湘琳)


