1 引言(Introduction)
鈾是核電產業和核技術應用領域中非常重要的戰略性資源,隨著鈾礦的大量開采和濕法冶金技術的成熟,產生了大量的濃度低于1 mg·L-1的含鈾廢水,這些低濃度的含鈾廢水隨著環境的遷移和食物鏈的富集,不可避免地會進入環境,從而對自然生態環境和人類健康構成潛在的威脅.近年來,國內外眾多研究人員廣泛關注于高濃度含鈾廢水(初始鈾濃度大于50 mg·L-1)的處理,并取得了顯著的成果,然而對于低濃度的含鈾廢液(放射性活度濃度范圍為37~3.7×105 Bq·L-1(魏廣芝等,2007)的處理關注卻相對較少,且濃度越低處理難度越大.目前,化學(混凝)沉淀、離子交換、蒸發濃縮、吸附是處理放射性含鈾廢水的基本工藝,但在實際應用中這些方法對于處理離子濃度在1~100 mg·L-1的低濃度含鈾廢水,存在著高能耗、低效率、高成本、需二次廢物處理等問題.多年來,研究人員一直致力于探尋新的高效經濟的低濃度含鈾廢水的處理技術,1991年美國學者首次揭示了微生物能夠還原鈾,開創了微生物與鈾相互作用的新時代,微生物處理含鈾廢水的技術從而得到了廣泛的重視和發展(胡戀等,2007).同時,研究人員們還發現,這些生物吸附劑擁有良好的金屬結合能力,在特殊條件下還能實現特異性選擇吸收某些金屬離子,能夠很好地降低溶液中金屬離子濃度(從μg·L-1降低到ng·L-1).利用微生物吸附低濃度放射性廢水是一種新型高效的處理方法,具有低成本、耗能少、無二次污染等優點,并能與其他工藝相結合實現工業生產化.在眾多微生物吸附劑(細菌、真菌、藻類)中,選用發酵工業的廢棄菌體作為吸附劑,不僅可以降低生物吸附劑的成本,還可使其具有工業化應用的潛力.面包酵母作為一類重要且廉價的工業微生物,突顯其作為生物吸附劑的優越性:安全無毒性、來源穩定易培養、理想模式生物可在分子水平上研究其吸附機理(陳燦等,2006).同時,研究發現,酵母菌可以去除多種重金屬,并且對于放射性核素鈾的吸附量較高,在競爭吸附中占據優勢地位,受因素干擾較小.目前,關于酵母菌對放射性核素鈾的吸附能力和機理研究中,大部分研究者使用的都是活體酵母菌,也有部分研究人員研究死體酵母菌,發現其具有與活體酵母相似甚至更好的吸附效果,而對于活、死菌吸附機理的研究卻很少有人關注.本文基于近年來國內外的研究成果及自身的研究工作,探究活性與滅活面包酵母對低濃度放射性核素鈾在不同酸堿度、吸附時間、吸附劑濃度條件下的吸附差異,并對吸附動力學特性進行分析,最后討論其不同的吸附機理,以期為后續發展的生物吸附工藝提供一定的參考.
2 材料和方法(Materials and methods) 2.1 實驗材料 2.1.1 主要儀器與試劑
WGJ-Ⅲ型微量鈾分析儀,恒溫培養搖床,TG16-WS臺式高速離心機,立式壓力蒸汽滅菌器,傅立葉變換-紅外光譜儀,JSM-6701F冷場發射型掃描電鏡.硝酸鈾酰及其他試劑均為分析純.
2.1.2 菌株的選擇與制備
實驗所用菌種為市售的安琪酵母有限公司生產的面包酵母.稱取一定量的干酵母加入到2%的滅菌葡萄糖溶液中活化,將活化后的菌體種子液接入到無菌YPD(1%酵母提取物、2%蛋白胨、2%葡萄糖)液體培養基中,于恒溫培養搖床(30 ℃,200 r·min-1)中振蕩培養30 h后,離心(5000 r·min-1,5 min)收集菌體,將收集到的菌體用無菌去離子水反復清洗3次,然后將其中一部分稀釋成菌體懸浮液,置于4 ℃ 冰箱中保存備用;將另一部分稀釋的菌體懸浮液在0.15 MPa、121 ℃ 立式壓力蒸汽滅菌器中滅活20 min,得到滅活酵母,置于4 ℃ 冰箱中保存備用.
2.1.3 鈾溶液配置
準確稱取一定量的硝酸鈾酰[UO2(NO3)2·6H2O],溶解于0.01 mol·L-1的硝酸溶液中,配制成1 mg·mL-1的標準儲備鈾溶液,然后用0.001 mol·L-1硝酸水逐級稀釋得到10 mg·L-1的實驗用鈾溶液.實驗過程中使用NaOH、HNO3調節溶液pH值,為了減小外加陽離子對吸附過程的影響,在批次實驗中Na+離子強度設置為0.01 mol·L-1.
2.2 實驗方法 2.2.1 吸附實驗
取容積為40 mL的離心管,根據不同實驗目的,加入一定體積的活性酵母菌懸浮液和3 mL 0.1 mol·L-1硝酸鈉溶液于搖床上恒溫振蕩混合(200 r·min-1,30 min)后,加入3 mL 10 mg·L-1鈾溶液(保持吸附系統中初始鈾離子濃度為 1 mg·L-1),在搖床上恒溫振蕩吸附(200 r·min-1),一定時間后取樣離心(10000 r·min-1,15 min),取上層清液測定其中鈾離子濃度.滅活酵母菌與活性酵母菌實驗操作過程完全一致.
2.2.2 計算方法
鈾濃度利用微量鈾分析儀工作曲線法測定,鈾的吸附量及吸附率用下式表示:


式中,Q為吸附量(mg·g-1),R為吸附率,C0為初始溶液中鈾離子濃度(mg·L-1),Ce為吸附后溶液中鈾離子濃度(mg·L-1),Cm為加入酵母菌懸浮液的質量濃度(g·L-1).
2.3 分析測試
由于鈾溶液濃度太低不利于樣品的觀測,因此,在制作分析樣品時,將鈾溶液濃度提高至100 mg·L-1.
2.3.1 掃描電鏡樣品制備
離心收集吸附前后的活性酵母與滅活酵母菌體,加入2.5%戊二醛溶液固定1 h后除去戊二醛,清洗后用潔凈的膠頭滴管將菌體置于潔凈拋光的錫箔紙上,依次用20%、50%、80%、100%的乙醇溶液梯度脫水處理,待自然晾干后,噴金處理,置于JSM-6701F冷場發射型掃描電鏡下觀測,得到菌體的顯微圖像.
2.3.2 紅外光譜樣品制備
離心收集吸附前后的活性酵母與滅活酵母菌體,置于30 ℃恒溫干燥箱中干燥備用.采用KBr壓片法,在相同的頻率波長下測定紅外吸收光譜.
3 結果與分析(Results and analysis) 3.1 pH值對鈾吸附效果的影響
吸附系統pH值不僅決定著酵母菌表面電荷位點分布和硝酸鈾酰在液相中的水解及其絡合形態,還會影響生物吸附劑表面官能團的結構與性能(吳海云等,2010;Popa et al.,2003),因此,在實驗中系統的酸堿度會影響鈾離子與酵母菌表面吸附位點的結合程度.不同pH值下,活性酵母菌與滅活酵母對鈾酰離子的吸附效果如圖 1所示.

圖 1 pH值對不同活性酵母菌吸附鈾的影響(a)及滅活酵母菌與活性酵母菌對鈾吸附量比值(Q2/Q1)(b)(C0=1 mg·L-1,t=4 h,T=26 ℃,Cm=0.20 g·L-1)
從圖 1a可以看出,pH值在3.0~5.0的范圍內,活性酵母菌對鈾的吸附率從8%增長到48%,基本呈線性增長趨勢,滅活酵母菌對鈾的吸附率始終保持在85%左右,變化不明顯;而pH值在5.5~7.0的范圍內,滅活酵母菌對鈾的吸附率從84%下降至56%,呈線性下降趨勢,活性酵母菌對鈾的吸附率僅從50%下降至38%,下降趨勢較緩.活性酵母菌對低濃度鈾的最佳吸附pH值在5.5左右,吸附率達到50%,而滅活酵母菌的最佳吸附pH值在4.5左右,吸附率達到87%.從圖 1b可以進一步看出,在酸性(pH=3)條件下,滅活酵母菌對鈾的吸附量可以達到活性酵母菌的11倍,隨著pH值的升高,滅活酵母菌與活性酵母菌的這種吸附差異逐漸減小,說明滅活酵母菌相對于活性酵母菌更能適應含低濃度鈾的酸性水溶液.
3.2 時間對鈾吸附效果的影響
以時間為變量,研究了活性酵母與滅活酵母菌對鈾離子吸附的動態平衡過程,結果如圖 2所示.從圖 2可以看出,吸附前30 min活性酵母菌與滅活酵母菌對鈾的吸附速率近似相同,都保持較快的增長速率.此后,滅活酵母菌對鈾的吸附速率趨于零,達到動態平衡狀態,而活性酵母菌對鈾的吸附速率趨緩,但仍保持著增長的趨勢,240 min后才逐漸達到動態平衡,300 min后,滅活酵母菌對鈾的吸附率(85%)明顯高于活性酵母菌對鈾的吸附率(70%).通常生物吸附過程被分為被動吸附和主動吸附兩種模式,前者是一個快速過程,不需要消耗能量,主要依靠細胞壁上的官能團與金屬離子之間的物理作用進行吸附,這個過程在活體與滅活的菌體吸附劑中都是主要過程;后者是一個相對緩慢的過程,需要依賴于能量及代謝系統的調控,主要通過細胞內酶促作用進行生物轉運、生物沉淀和生物積累,僅見于活體吸附系統中.因而對整個吸附過程來說,滅活酵母菌對鈾的吸附是一個快速穩定的不消耗能量的過程,而活性酵母菌對鈾的吸附則是一個相對緩慢的依靠自身代謝調控的過程.

圖 2 反應時間對不同活性酵母菌吸附鈾的影響(pH=5.0±0.1,C0=1 mg·L-1,T=26 ℃,Cm=0.16 g·L-1)
3.3 菌濃度對吸附效果的影響
探究了活性酵母與滅活酵母初始菌濃度對鈾的吸附率及吸附量的影響,結果如圖 3所示.從圖中可以看出,當初始菌體投加量由0.064 g·L-1增至0.32 g·L-1時,活性酵母菌對鈾的吸附率由62%提高到78%,滅活酵母菌僅從79%提高到87%.說明在低濃度鈾的條件下,活性酵母菌對鈾的吸附能力受初始菌濃度影響較大,隨著菌濃度的升高,細胞表面吸附位點增加,有利于活性酵母菌對鈾的吸附作用.當活性酵母菌與滅活酵母菌對鈾的吸附系統到達相同狀態時,活性酵母菌的初始濃度為0.32 g·L-1,而滅活酵母菌的初始濃度為0.064 g·L-1,僅為活性酵母菌濃度的1/5,且吸附量(12.42 mg·g-1)是活性酵母菌(2.45 mg·g-1)的6倍.進一步表明了在低濃度鈾的條件下,滅活酵母菌對鈾的吸附能力高于活性酵母菌,因此,在要求高效經濟的吸附生產工藝中,應優先選用失活細胞體.
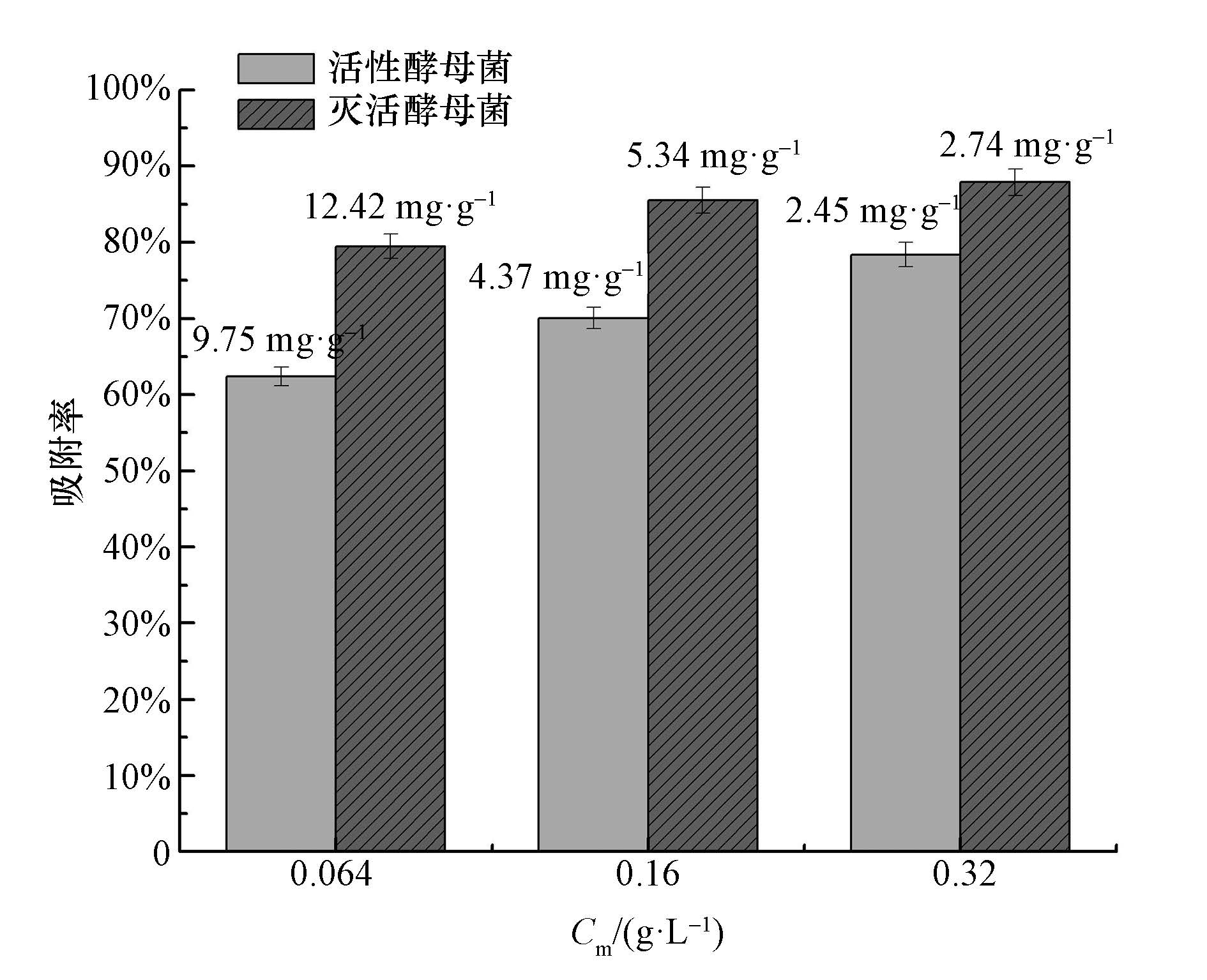
圖 3 不同活性菌體投加量對吸附鈾的影響(pH=5.0±0.1,t=4 h,C0=1mg ·L-1,T=26 ℃;柱狀圖上方數據為吸附量)
3.4 溫度對吸附效果的影響
在不同溫度環境條件下,活性酵母和滅活酵母對鈾的吸附能力如圖 4所示.從圖中可以看出,活性酵母菌(菌濃度0.32 g·L-1)對鈾離子的最佳吸附溫度為26 ℃,溫度降低或升高,對于活性酵母菌吸附鈾都有適當的抑制作用.這是由于溫度較低時,酵母菌表面吸附位點的活性不強,而在較高溫度下,這些表面吸附位點又失去了活性,從而說明活性酵母菌對鈾的吸附過程要依賴于自身代謝系統的調控.而對于滅活酵母菌(菌濃度0.064 g·L-1),經過高溫高壓的作用,細胞表面的吸附位點已經失去活性,溫度對滅活酵母菌的吸附能力影響不明顯,但隨著時間的延長,適當提高溫度對吸附還是有促進作用,說明滅活酵母菌對鈾的吸附是一種吸熱反應,同時也表明滅活酵母菌是一種能夠適應較寬溫度范圍的生物吸附劑(代群威等,2008).
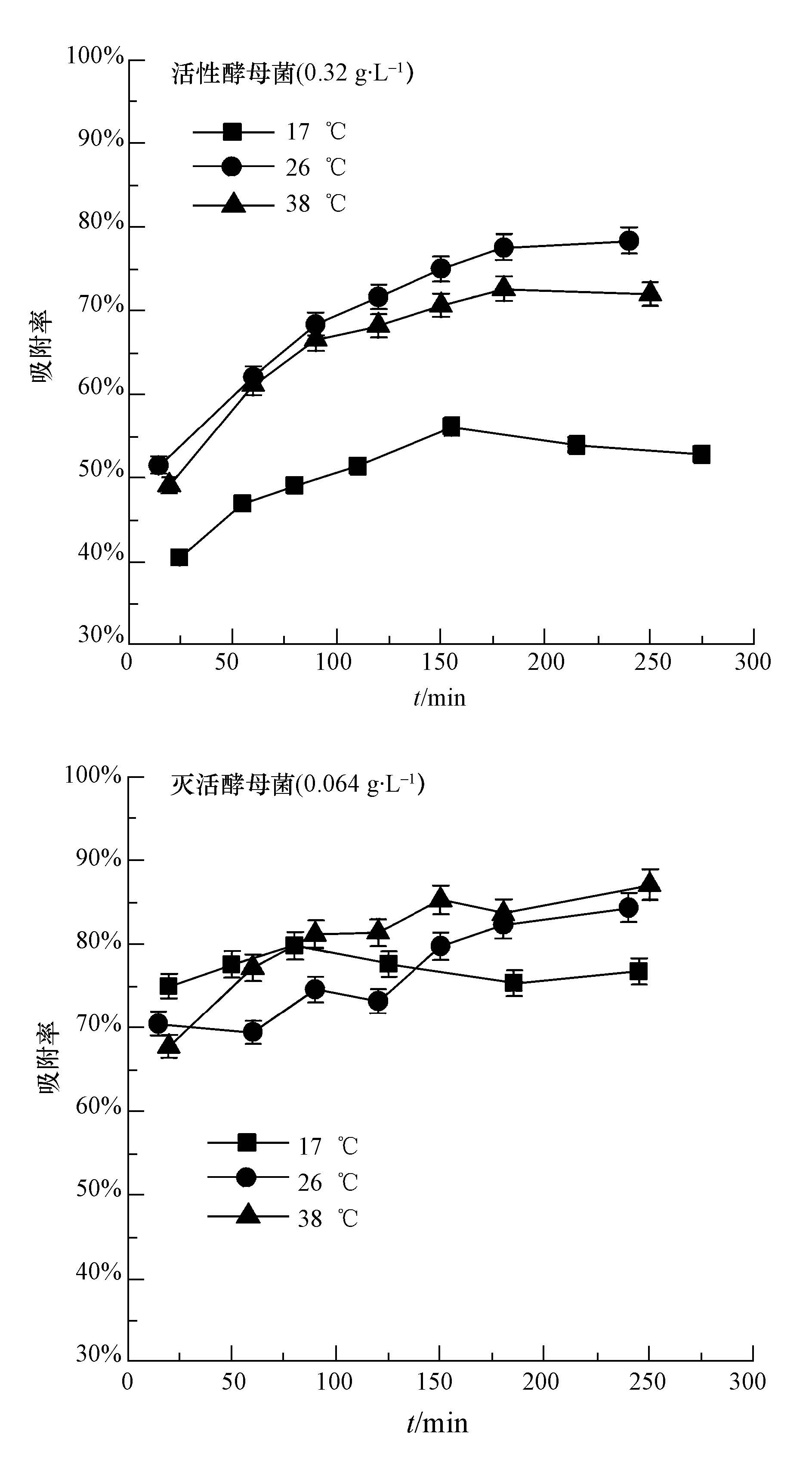
圖 4 溫度對不同活性酵母菌吸附鈾的影響(pH=5.0±0.1,C0=1 mg·L-1)
3.5 吸附動力學分析
利用動力學分析可以進一步探討酵母菌對鈾酰離子的吸附機理,常用的離子動力學方程有準一級吸附動力學方程、準二級吸附動力學方程等.相比于準二級動力學模型,利用準一級動力學模型進行擬合需已知平衡吸附量,而對于生物吸附這種動態平衡過程來說,許多情況下平衡吸附量是未知的,因而用準二級動力學模型能夠更好地揭示整個生物吸附的行為過程,并與速率控制步驟一致.準二級動力學表達式如式(3)所示,經分離變量,積分可得式(4).


式中,qe為平衡時的理論吸附量(mg·g-1),qt為t時刻的吸附量(mg·g-1),K2為準二級吸附速率常數(g·mg-1·min-1).
用式(4)分別對活性酵母與滅活酵母在不同溫度下吸附鈾的動力學過程進行研究,得到的擬合曲線如圖 5所示,模型擬合參數見表 1.

圖 5 不同溫度下不同活性酵母菌對鈾的吸附動力學擬合(pH=5.0±0.1,C0=1 mg·L-1)
從表 1可以看出,不同溫度下活性酵母菌與滅活酵母菌對鈾離子的準二級動力學吸附速率方程擬合結果較好,R2均在0.99以上.一般來說,準二級動力學模型是假定吸附速率受化學吸附機理的控制,而這種化學吸附涉及到吸附劑與吸附質之間的電子共用或電子轉移(Sarada et al.,2014),這就說明無論是活性酵母菌還是滅活酵母菌對鈾的吸附過程中,都存在著化學吸附過程,并且這種化學吸附機制表現為菌體表面吸附位點與鈾離子間的電子共用或電子轉移.
表 1 不同溫度下不同活性酵母菌對鈾吸附的準二級動力學模型擬合參數
3.6 掃描電鏡結果與分析
圖 6為吸附前后活性酵母與滅活酵母菌體的掃描電鏡圖,從圖中可以明顯看出,吸附鈾前后活性酵母菌與滅活酵母菌菌體表面形貌的差異.吸附前活性酵母菌細胞表面完整光滑(圖 6a),在與鈾離子作用2 h后(圖 6b),只有少量的鈾離子沉淀物不均勻地附著在細胞表面,沉淀物聚集成小塊狀,同時細胞表面出現凹陷,形成空洞,表明鈾離子開始與酵母細胞作用,這與劉明學等(2011)的研究結果一致.而經過高溫高壓滅活的酵母菌,在吸附鈾離子前(圖 6c),細胞雖保持完整,但表面出現褶皺,有明顯突起,使其表面積增大,為鈾離子的結合提供了更多的吸附位點,同時驗證了滅活酵母菌的高吸附能力.由于滅活酵母菌對鈾的吸附速率很快,僅30 min就達到動態平衡,因而在與鈾離子作用2 h后(圖 6d),大量的納米顆粒狀鈾離子沉淀不均勻地附著在細胞表面,并成簇狀向上生長.
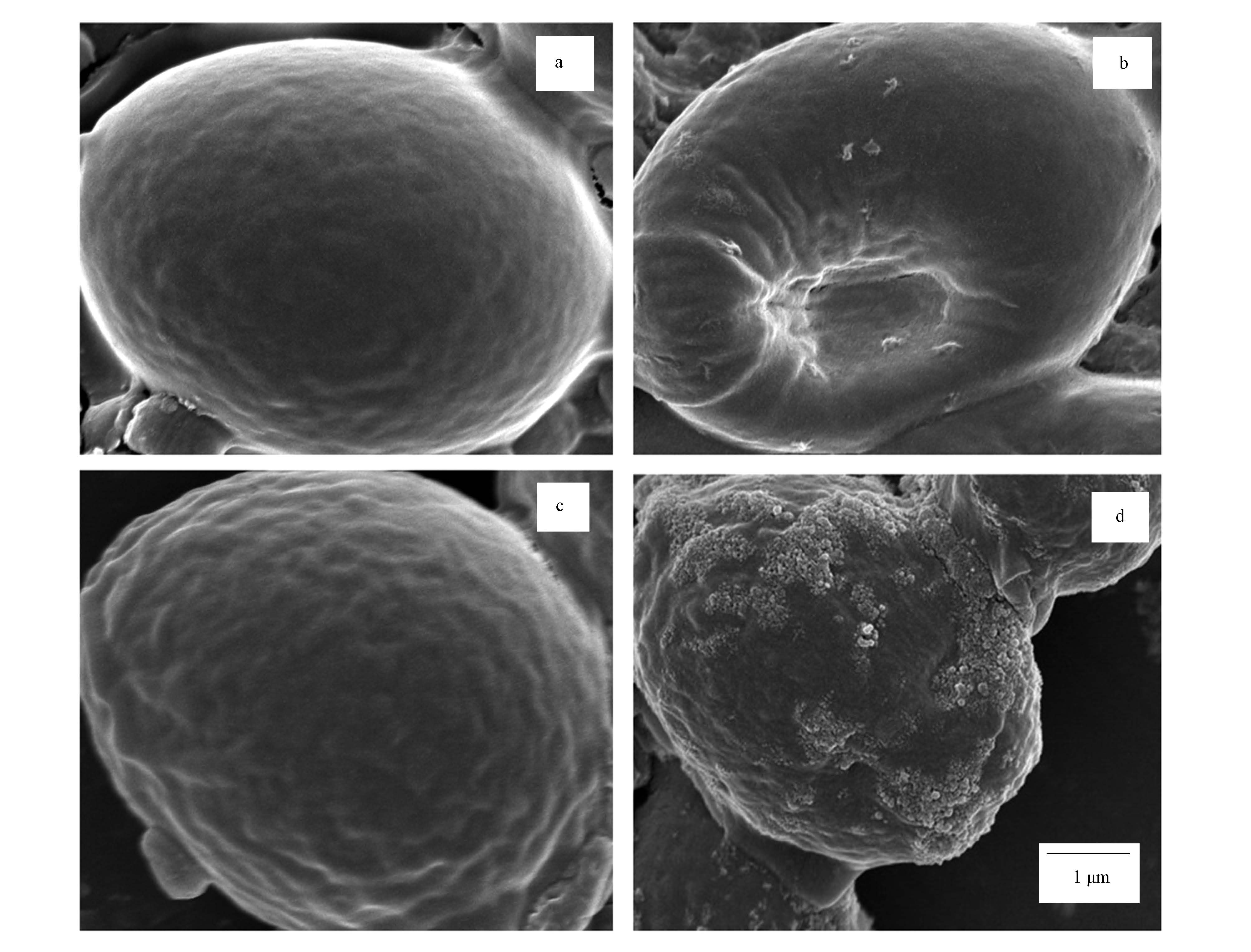
圖 6 吸附前后活性與滅活酵母菌掃描電鏡圖(a.吸附前活性酵母菌,b.吸附后活性酵母菌,c.吸附前滅活酵母菌,d.吸附后滅活酵母菌;×15000;pH=5.0±0.1,t=2 h,C0=100 mg·L-1,Cm=1.60 g·L-1,T=30 ℃)
3.7 紅外光譜分析
圖 7為吸附鈾前后活性酵母菌與滅活酵母菌的紅外光譜圖.研究表明,吸附的鈾酰離子主要沉積在細胞的表面即細胞壁上,因為細胞壁上的活性基團可以與金屬離子發生定量的結合反應(白靜等,2009).面包酵母菌細胞壁主要由葡聚糖、甘露聚糖、蛋白質和脂類,還有部分的幾丁質(N-乙酰葡萄糖胺,以1-4葡萄糖苷鍵連接的多聚體)等組成(胡家駿等,1988).因面包酵母菌組成成分比較復雜,使得樣品在整個波數段(400~4000 cm-1)內均有明顯吸收,這樣某些峰未能表現出來,一些不太靈敏的吸收峰被掩蓋.

圖 7 吸附鈾前后活性與滅活酵母菌紅外光譜圖(pH=5.0±0.1,t=2 h,C0=100mg·L-1,Cm=1.60 g·L-1,T=30 ℃)
從活性酵母菌吸附前后的紅外光譜圖(圖 7)可見,活性酵母菌吸附鈾后—OH的伸縮振動由3434.37 cm-1向低波數移動到3378.65 cm-1,說明—OH參與絡合鈾酰離子,—OH鍵鍵長增長,峰值發生紅移,這與劉明學等(2011)的研究結果一致.2100 cm-1左右為C≡C伸縮振動帶,吸附鈾后峰值向低波數移動了11 cm-1,說明鈾酰離子取代了C≡C兩端的某些基團,使分子的對稱性降低,吸收頻率向低頻發生偏移(翁詩甫,2010).1643 cm-1處歸屬于醛羰基CO伸縮振動吸收帶,1551 cm-1處的吸收峰為酰胺II帶,1242 cm-1為酰胺III帶,由N—H鍵的彎曲振動和C—N鍵的伸縮振動耦合而成(白靜等,2009),在與鈾發生相互作用后,這些峰都發生了偏移.綜合紅外光譜的變化情況來看,在活性酵母菌對鈾離子的吸附過程中,羥基、醛羰基、N—H、C—N等為主要的吸附位點.
相對于活性酵母菌,經過高溫高壓作用的滅活酵母菌在吸附前,2100 cm-1左右的吸收譜帶幾乎完全消失,蛋白質吸收特征峰(由活性酵母的1643、1551、1242 cm-1分別移動至滅活酵母的1651、1536、1239 cm-1)出現了漂移,說明在高溫高壓作用下細胞表面結構還是保持完整,只是某些蛋白質類物質變性,C≡C斷裂,使譜峰出現了消失和漂移.
從滅活酵母菌吸附前后的紅外光譜圖(圖 7)可看出,在3300~3400 cm4-1之間,峰位由3386.57 cm-1向高波數移動到3434.23 cm-1,可能是由—OH和—NH2的伸縮振動引起的,這與其他學者的發現一致.1651 cm-1處歸屬于酮羰基CO伸縮振動吸收帶,1536 cm-1和1239 cm-1是N—H鍵的彎曲振動和C—N鍵的伸縮振動,可能有PO伸縮振動的貢獻.1072.50 cm-1處是磷酸基—HPO2- 的對稱伸縮振動帶,與鈾離子結合后向低波數偏移了7 cm4-1.因此,滅活酵母菌對鈾離子的吸附過程中,羥基、酮羰基、PO、—HPO2-等為主要的吸附位點.
比較圖 7中吸附前后活性酵母與滅活酵母的紅外光譜可以發現,在918.25 cm-1和916.15 cm-1處為新出現的峰位,這是一個含鈾的特征峰,為UO22+的伸縮振動峰,說明活性酵母與滅活酵母對鈾離子確實發生了吸附作用,菌體表面的吸附位點與鈾離子形成配合物,表現為表面絡合吸附機制.
4 結論(Conclusions)
1) 活性酵母與滅活酵母對低濃度含鈾溶液都有一定的吸附能力,但滅活酵母菌對低濃度鈾的吸附效率明顯高于活性酵母菌,且更能適應含低濃度鈾的酸性水溶液.
2) 準二級動力學模型的擬合結果表明,活性與滅活酵母在對鈾的吸附過程中都存在著電子共用或電子轉移過程,這種電荷間的相互作用是一種物理化學現象,說明微生物對鈾離子的吸附過程中被動吸附過程為主要的吸附形式.具體參見污水寶商城資料或http://www.bnynw.com更多相關技術文檔。
3) 掃描電鏡結果證實了滅活酵母菌的高吸附能力.紅外光譜分析進一步說明了活性酵母與滅活酵母菌吸附機理的不同,活性酵母菌對鈾離子的吸附過程中,羥基、醛羰基、N—H、C—N等為主要的吸附位點,提供這些吸附位點的主要為多糖和蛋白質類物質;而滅活酵母菌對鈾離子的吸附過程中,羥基、酮羰基、PO、—HPO42-等為主要的吸附位點,提供這些位點的主要為多糖和磷酸類物質.說明滅活酵母菌經過高溫高壓的作用,細胞表面蛋白質類物質變性,細胞膜通透性增加,使其胞內磷酸物質大量釋放,大大增加了自身結合鈾離子的能力,使滅活酵母菌對鈾酰離子的吸附成為一種快速、穩定、高效的吸附過程.而對于活性酵母菌來說,細胞膜的通透性并沒有發生改變,在鈾離子吸附過程中會選擇性吸附,并且細胞自身也會做出不同的調控反應,如在吸附過程中細胞出現凹陷等,這些都說明了活性酵母菌對鈾離子的吸附不僅依賴于細胞表面活性位點的被動吸附,同時還要依賴于自身代謝系統的調控及其代謝產物等.



