重金屬有著潛在的毒性和環(huán)境持久性,成為最危險的人類環(huán)境污染物之一. 銻的大部分化合物對人體有害,并證明可以致癌,已被美國國家環(huán)保署(EPA)和歐盟(EU)列為優(yōu)先控制污染物[1, 2, 3]. 在天然水體中,銻主要存在形態(tài)有: Sb(Ⅲ)、 Sb(Ⅴ)、 有機銻(包括一甲基次銻酸和二甲基次銻酸),其中在銻礦區(qū)的尾礦堆周圍的表層水中,銻以Sb(Ⅴ)形式為主[4]. 根據(jù)熱力學平衡方程,Sb(Ⅲ)主要存在于還原環(huán)境中,Sb(Ⅴ)主要存在于氧化環(huán)境中. 自然界中Sb(Ⅲ)與Sb(Ⅴ)之間也有著相互轉(zhuǎn)化的關系,例如,表層水等氧化水體中,Sb(Ⅲ)可被水中溶解的氧氣和過氧化氫氧化成Sb(Ⅴ)[5],同時,在還原性水體中,水中存在的硫化物,L-半胱氨酸等還原性物質(zhì)可以將Sb(Ⅴ)還原為Sb(Ⅲ)[6]. 中國是Sb儲存和生產(chǎn)大國,Sb儲量占世界儲量的一半以上,在1998~2008年間,世界Sb總產(chǎn)量(1.5×105 tons)的84.0%來自于中國,開采和冶煉產(chǎn)生的廢渣廢水排入環(huán)境中,會使環(huán)境中Sb濃度超標[7]. 有研究[8]發(fā)現(xiàn)銻礦廢渣及銻冶煉固廢中采礦廢石浸出液Sb的濃度為3.55 mg ·L-1; 鼓風爐燃燒殘渣浸出液Sb的濃度為3.11 mg ·L-1,均超過排放標準數(shù)倍(涉銻企業(yè)外排廢水中銻的標準限值為 0.5 mg ·L-1[9],地表水中銻的限值定為5 μg ·L-1[10]). 用于冶煉的銻礦石主要是輝銻礦(Sb2S3)、 輝銻鐵礦(FeSb2S4)、 斜硫銻鉛礦(Pb5Sb8S17)等[11],堆積的銻礦石受氧化、 淋濾、 微生物效應等因素影響也會使有毒銻元素被溶出,這些高濃度含銻溶液如若進入水中會造成水體污染,同時會對周邊環(huán)境及居民身體健康造成嚴重危害[12,13]. 目前國內(nèi)外對銻礦廢水的處理研究較少,主要方法有沉淀法、 電化學沉積法、 凝聚法、 微生物法和吸附法等[14, 15, 16, 17, 18]. 這些方法雖各有特點,但都存在一定局限性,可能存在處理時間過長,成本過高或二次污染等問題,大部分在去除銻的過程中沒有進行回收方面的研究[19].
本研究擬用電化學氫化物法處理銻礦廢水及對銻進行回收. 目前電化學氫化物法主要應用于原子熒光光譜測樣技術中的氣相進樣步驟的氫化物氣體的產(chǎn)生. 電化學氫化物法也運用于其他領域: Turygin等[20]運用電化學氫化物法電解生成AsH3、 PH3等氫化物對半導體材料制造流程的改進; Bejan等[21]用7~9個串聯(lián)的連續(xù)流動的電解裝置,在酸性和堿性條件下運用玻璃管碳電極電解處理100 mg ·L-1 As(Ⅲ),最終處理效果As濃度低至20 μg ·L-1,并判斷電解產(chǎn)生的唯一產(chǎn)物為砷化氫. 銻與砷、 磷處于同一主族,化學性質(zhì)類似. 因此,本研究采用電化學氫化物發(fā)生法使銻轉(zhuǎn)化為銻化氫逸出,達到去除水中銻的目的,收集并加熱銻化氫使其分解得到金屬銻,達到回收銻的目的.
1 實驗原理
銻會與活潑態(tài)氫原子發(fā)生反應生成金屬氫化物,活潑態(tài)氫原子的產(chǎn)生方式有兩種: 其一是化學法: KBH4+3H2O+H+→8H ·+H3BO3+Na+,另一種方法是電化學法產(chǎn)生. 本研究采用電化學法產(chǎn)生活潑態(tài)氫原子與溶液中銻結(jié)合生成銻化氫,用于礦山廢水銻污染的處理,去除機制可歸納為Sb(Ⅲ)+3H ·+6e-→SbH3↑,理論上Sb(Ⅴ)在反應過程中須先被還原為三價再繼續(xù)反應.
在銻回收方面,由于SbH3熱穩(wěn)定性差,受熱分解生成具有金屬光澤的黑色沉積物——元素銻,同時放出氫氣[22]. 對反應生成的SbH3氣體進行收集還原,基本原理為2SbH3→3H2↑+2Sb.
2 材料與方法
2.1 實驗裝置
實驗儀器主要由以下部分組成: 自制電解槽反應器(總?cè)萘?0 mL,單室容量45 mL); 陽極材料(鉛、石墨、鎢絲); 陰極(石墨棒); 選擇性離子交換膜(陽離子交換膜,2 cm×5 cm,浙江千秋公司); TPR3010S可調(diào)直流穩(wěn)壓電源(上海安信泰公司); 攪拌子(3 mm×12 mm); CJJ79-1磁力加熱攪拌機(江蘇金壇大地自動化儀器廠). 回收裝置由電爐和石英管組成. 樣品測定儀器為AFS-2202E雙道氫化物發(fā)生原子熒光光度計(北京海光儀器有限公司).
2.2 試劑配置
稱取0.274 3 g 酒石酸銻鉀,1 g抗壞血酸,定容至100 mL,以此為1 000 mg ·L-1Sb(Ⅲ)標準儲備液. 稱取0.108 0 g 六羥基銻酸鉀,加入5 mL濃鹽酸溶解,定容至100 mL,以此為1 000 mg ·L-1 Sb(Ⅴ)標準儲備液. 實驗用模擬含銻廢水為實驗試劑對標準儲備液進行稀釋制得. 實驗時有兩種基本實驗情形. 一是對電解液的pH不進行控制,任其變化: 不控制pH時電解質(zhì)為0.4 mol ·L-1 K2SO4由34.8 g K2SO4定容至500 mL制得. 二是用緩沖液控制電解溶液的pH,使pH變化很小: pH=4緩沖溶液由34.0 g NaAc溶解后用HAc滴定至pH=4后定容至250 mL制得,pH=7緩沖溶液由13.6 g KH2PO4和22.8 g K2HPO4溶解后定容至100 mL制得,pH=10緩沖溶液由10 g KHCO3和13.8 g K2CO3溶解后定容100 mL制得.
2.3 測樣方法
標準溶液配置: 用100 mg ·L-1 Sb標準溶液稀釋至1 mg ·L-1,分別移取0、 0.125、 0.25、 0.5、 0.75、 1 mL于25 mL容量瓶中,加入5% 硫脲與 5% 抗壞血酸混合液5 mL,加入1.25 mL濃鹽酸,定容后得0、 5、 10、 20、 30、 40 μg ·L-1的銻標準系列溶液. 上機測試數(shù)據(jù)擬合得出標準曲線.
測樣樣品配置: 取0.25 mL樣品于25 mL容量瓶中,加入5% 硫脲與 5% 抗壞血酸混合液5 mL和1.25 mL濃鹽酸,定容至25 mL,樣品稀釋倍數(shù)為100倍.
AFS測樣參數(shù): 負高壓240 V、 銻燈總燈電流40 mA、 輔陰極電流20 mA、 載氣流量300 mL ·min-1、 屏蔽氣流量800 mL ·min-1.
AFS測樣原理: 酸化后的待測溶液,加入的硫脲-抗壞血酸混合溶液把Sb(Ⅴ)還原為Sb(Ⅲ),同時絡合去除其它金屬離子的干擾,進樣時Sb(Ⅲ)與硼氫化鉀反應生成揮發(fā)性SbH3,以氬氣為載氣,將氫化物導入電熱石英原子化器中原子化,在銻的空心陰極燈照射下,銻元素的基態(tài)原子被激發(fā)至高能態(tài),當回到基態(tài)時,發(fā)射出特征波長的熒光,其熒光強度與含量成正比[23]. 把測得的熒光信號強度與標準溶液熒光強度擬合出來的標準曲線進行對比可得樣品濃度.
2.4 氫化物發(fā)生與回收操作步驟
由于在電解過程中Sb(Ⅲ)接觸陽極會被氧化形成Sb(Ⅴ)[24],影響實驗結(jié)果. 因此氫化物發(fā)生裝置采用離子交換膜分隔陰陽兩室. 陽極室注入0.4 mol ·L-1的Na2SO4,陰極室注入待處理銻溶液. 實驗裝置圖如圖 1(a)所示,實驗裝置簡化圖如圖 1(b)所示.
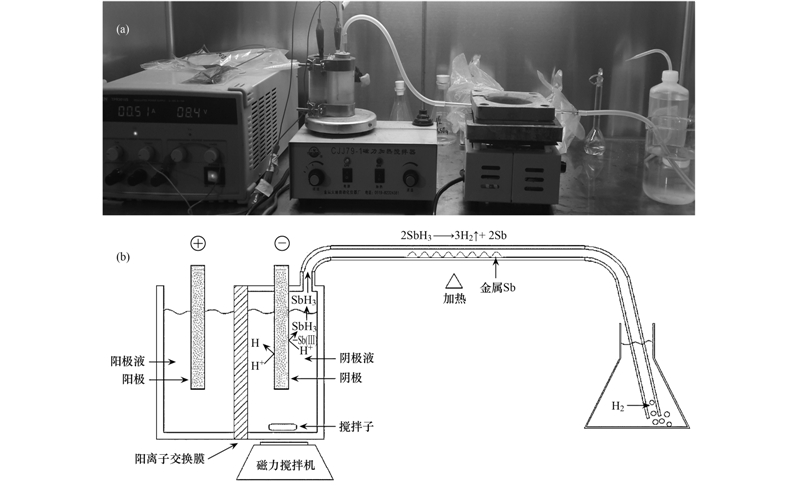
圖 1 氫化物發(fā)生法去除并回收廢水中銻的實驗裝置
電化學氫化物發(fā)生步驟: 實驗由可調(diào)直流穩(wěn)壓電源供電,電流恒流0.5 A. 電極用砂紙打磨后用超純水清洗,放入電解室中(圖 1). 電解時間為2 h,電解同時用磁力攪拌機進行攪拌. 按實驗要求時間間隔取樣,每次取樣0.5 mL樣品于試管中待測.
高溫加熱回收步驟: 如圖 1所示,電解過程同時把氣體導入到石英管中,并由電爐高溫加熱(溫度≥200℃),為保證氣體不流失回收實驗單獨進行,不采用時間間隔取樣,電解時間為2 h. 回收實驗結(jié)束后,取下電極用濃硝酸浸泡溶解電極表面沉積的銻,離子膜用1 ∶5硝酸浸泡溶解吸附形態(tài)銻,石英管用1 ∶5硝酸浸泡溶解銻鏡,浸泡時間為12 h. 3 結(jié)果與討論 3.1 實驗條件優(yōu)化 3.1.1 不控制pH時對銻的處理效果
在不控制pH的條件下分別對Sb(Ⅲ)和Sb(Ⅴ)溶液進行電化學氫化物發(fā)生實驗,實驗用濃度均為5 mg ·L-1(由0.4 mol ·L-1 K2SO4溶液稀釋標準儲備液制得). 電解過程中,前1 h 10 min取一次樣,后1 h 15 min取一次樣,共處理2 h. 從圖 2中可以看出,在不控制pH的情況下處理,對Sb(Ⅲ)和Sb(Ⅴ)均有去除效果,2 h后Sb(Ⅲ)剩余量為2.95 mg ·L-1,去除率為41.0%,Sb(Ⅴ)剩余量為3.48 mg ·L-1,去除率為27.9%. Sb(Ⅲ)去除率大于Sb(Ⅴ),同時可以看出pH值在10 min內(nèi)分別由3.72和2.75變化至13.63和13.71. pH值變化迅速對實驗條件的控制不利,需要考慮控制pH進行實驗.
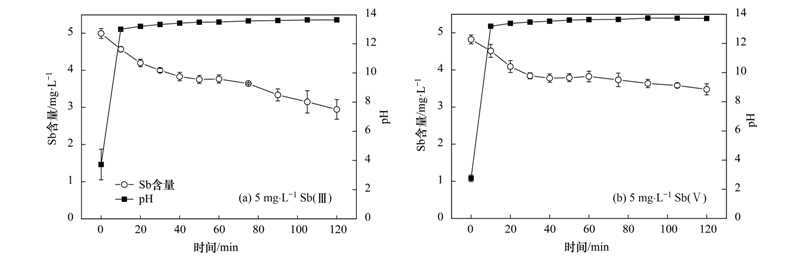
圖 2 不控制pH 條件下銻的剩余濃度隨時間變化
3.1.2 控制pH時對銻的處理效果
采用pH為4、 7、 10的緩沖溶液分別稀釋儲備液制得5 mg ·L-1的Sb(Ⅲ)和Sb(Ⅴ)溶液. 進行電化學氫化物發(fā)生實驗,取樣時間間隔同3.1.1節(jié)實驗. 實驗結(jié)果如圖 3所示,可以看出酸性條件(pH=4)下Sb(Ⅲ)有較好的去除效果,2 h后剩余濃度為1.19 mg ·L-1,去除率為76.1%,而Sb(Ⅴ)的情況則相反,在酸性條件下的去除率極低為10.1%,在堿性條件(pH=10)下有一定的去除效果,2 h后剩余濃度為2.63 mg ·L-1,去除率為44.2%.
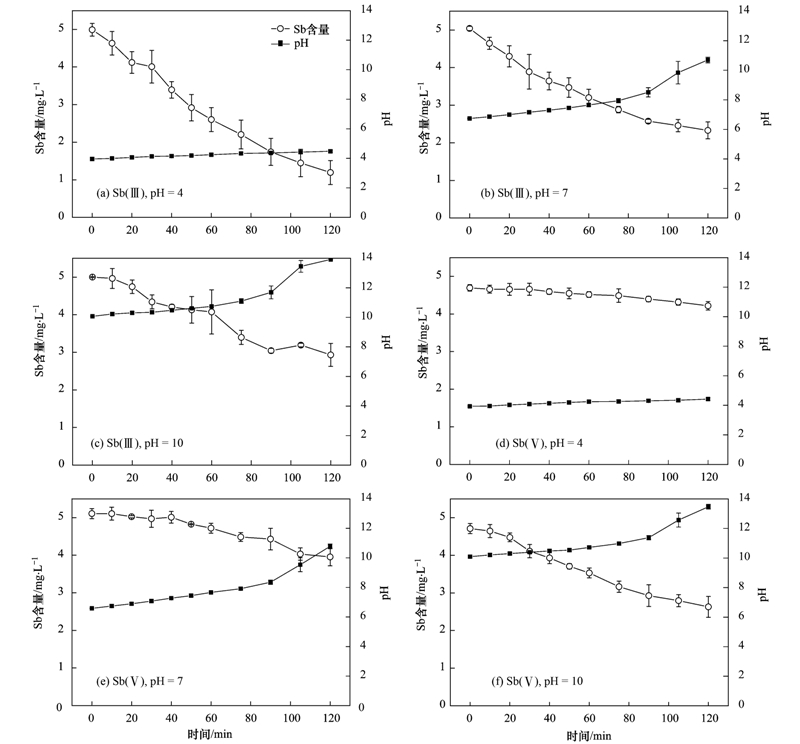
圖 3 不同pH下Sb(Ⅲ)、 Sb(Ⅴ)剩余濃度隨時間變化
為進一步證明酸性條件(pH=4)下Sb(Ⅲ)去除最好,同時Sb(Ⅴ)去除率較低. 實驗用1 mg ·L-1 Sb(Ⅲ)和相同濃度Sb(Ⅴ)混合液在酸性條件(pH=4)下進行實驗,如圖 4所示,在酸性條件下Sb(Ⅲ)基本被去除,2 h后剩余量為0.28 mg ·L-1,去除率為72.4%,Sb(Ⅴ)含量為總Sb含量減去Sb(Ⅲ)含量,只有極少量去除,剩余量為0.80 mg ·L-1,去除率為15.8%. 實驗證明了在pH=4的條件下Sb(Ⅴ)并不能很好地被去除.
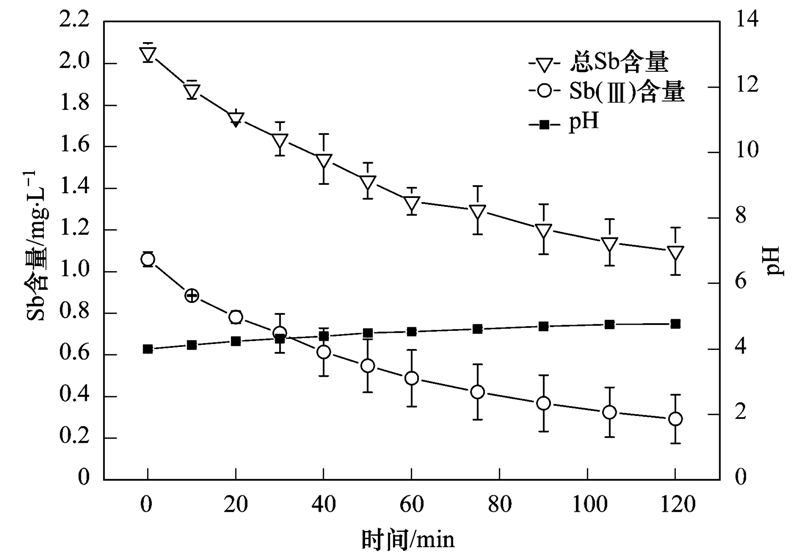
圖 4 Sb(Ⅲ)和Sb(Ⅴ)混合液在pH=4條件下剩余濃度隨時間的變化
3.1.3 電極材料的選擇
在陰極材料的選用上,分別試用了鉛、 鎢、 石墨這3種電解材料. 使用不同陰極材料在pH=4條件下對1 mg ·L-1的Sb(Ⅲ)進行時長為2 h的電化學氫化物發(fā)生實驗,并對溶液中銻的去除率進行了計算. 實驗結(jié)果如圖 5所示,鉛電極去除率為71.8%,石墨電極為58.5%,鎢電極為42.1%. 可見鉛比其他兩種材料有更好的處理效果,選用鉛為電極材料. 以上實驗結(jié)果的原因可能與電極的氫超電勢有關,氫超電勢的排序為: 鉛>石墨>鎢,氫化物生成是競爭原子態(tài)氫的過程,氫超電勢大的材料吸附原子態(tài)氫的能力弱,降低了氫氣的析出速率,增加了氫化物的生成速率[25].
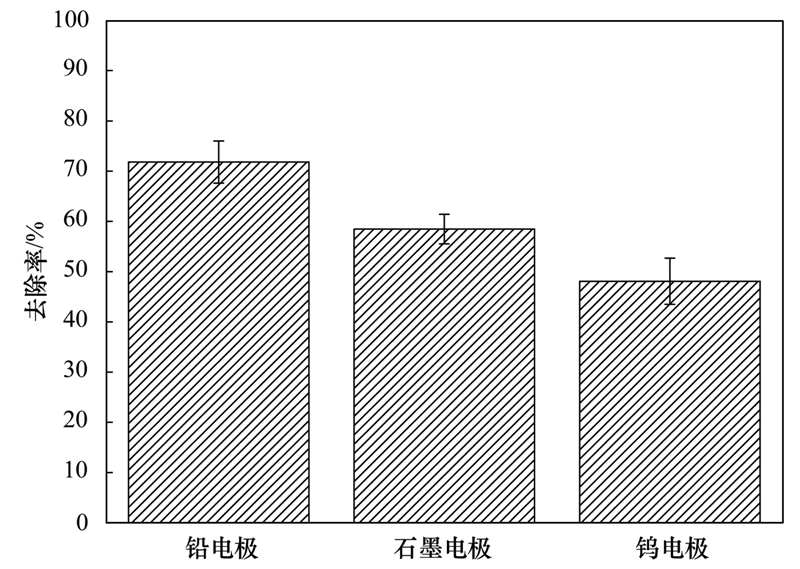
圖 5 不同電極材料對去除率效果的影響
3.1.4 初始濃度對銻去除的影響
分別用低濃度(1 mg ·L-1)與高濃度(5 mg ·L-1)的Sb(Ⅲ)溶液在最佳條件下(pH=4,鉛電極)進行電化學氫化物發(fā)生實驗,并進行對比. 如圖 6所示,處理2 h后低濃度(1 mg ·L-1)時剩余濃度為0.39 mg ·L-1,高濃度(5 mg ·L-1)時剩余濃度為1.19 mg ·L-1. 低濃度時去除率(71.8%)與高濃度時去除率(76.0%)接近,但是從去除絕對量來對比,2 h內(nèi)高濃度時去除了3.79 mg ·L-1,而低濃度時只去除了0.76 mg ·L-1,高濃度時去除的絕對量要高于低濃度時,認為在高濃度條件下,銻原子密度大有更多幾率與電解水產(chǎn)生的原子態(tài)氫結(jié)合生成銻化氫. 由于在低濃度下也有較好去除效果,所以在相對低濃度下此方法也適用于水溶液中銻的去除.
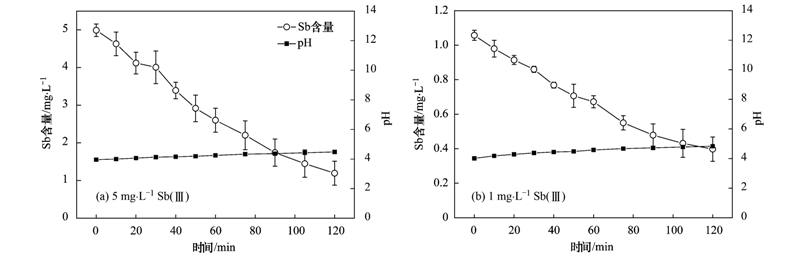
圖 6 不同銻濃度對去除的影響
3.2 銻去除途徑的探討與銻的回收
在銻溶液的電化學氫化物發(fā)生實驗過程中發(fā)現(xiàn)溶液中銻在實驗兩小時后都得到了一定程度的去除,推測銻的去除途徑有以下3點: ①銻在陰極上被還原后在陰極表面沉積; ②電解過程中離子膜對溶液中的銻有吸附作用; ③溶液中銻元素轉(zhuǎn)化為銻化氫氣體從溶液中脫除. 逸出的SbH3在加熱的石英管中會分解為Sb(圖 7),于是,用鉛電極在pH=4和pH=10條件下分別對5 mg ·L-1 Sb(Ⅲ)和Sb(Ⅴ)溶液進行2 h的回收實驗,測定電極上沉積的Sb,離子膜上吸附的Sb,以SbH3形式逸出并被加熱沉積的Sb. 圖 8是3種去除方式占總?cè)コ实谋壤?

圖 7 石英管中沉積的銻
Sb(Ⅲ)的3種去除途徑的實驗結(jié)果如圖 8(a)所示,石英管中Sb的含量最高,達到總?cè)コ康?6.2%,其次為電極(5.1%),最后是離子交換膜(4.1%). Sb(Ⅴ)的3種去除途徑的實驗測定結(jié)果如圖 8(b)所示,電極上Sb含量占總?cè)コ康?7.2%,離子膜占7.8%,石英管占15.8%.
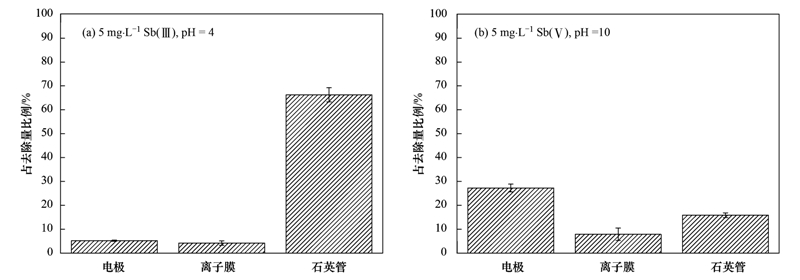
圖 8 3種方式對Sb(Ⅲ)和Sb(Ⅴ)去除的貢獻
從3種可能的去除途徑的實驗結(jié)果中可以看出,生成SbH3是Sb(Ⅲ)從溶液中去除的主要途徑,而不是Sb(Ⅴ)去除的主要途徑. Sb(Ⅲ)會在電化學氫化物發(fā)生實驗中轉(zhuǎn)化為SbH3氣體從溶液中脫除,通過收集SbH3氣體并加熱分解的方式可以進行銻的回收,Sb(Ⅴ)若要進行去除并回收需要一個預還原為Sb(Ⅲ)的過程. 實驗中3種去除途徑的含銻量總和低于溶液中銻的去除量,可能是膜上吸附的未完全洗脫下來,或者在電化學電解過程中產(chǎn)生沉淀,并吸附于容器表面或?qū)Ч苤校驗楹可俣鵁o法收集. 還有逸出的SbH3在加熱的過程中可 能并未完全沉積,因為加熱溫度偏低時SbH3難以 分解,而加熱溫度偏高時已沉積的金屬Sb可能會揮發(fā)而損失(金屬Sb熔點僅為730℃). 因此,溶液中的Sb被去除后的精確去向有待于SbH3分解-金屬Sb沉積的方法的改進.
具體參見污水寶商城資料或http://www.bnynw.com更多相關技術文檔。4 結(jié)論
(1)水溶液中的銻元素可以采用電解水產(chǎn)生活潑態(tài)氫與銻反應生成銻化氫氣體的方法進行去除.
(2)Sb(Ⅲ)的最優(yōu)去除條件為酸性條件. 與石墨和鎢電極相比,鉛電極的處理效果最佳.
(3)生成SbH3為電化學氫化物發(fā)生法去除Sb(Ⅲ)的主要途徑,而不是Sb(Ⅴ)去除的主要途徑,收集從溶液中脫除的SbH3氣體并加熱分解可達到回收金屬銻的目的,自然界有氧水環(huán)境中Sb的主要存在形式是Sb(Ⅴ),因此對Sb(Ⅴ)的去除并回收需要一個預還原為Sb(Ⅲ)的處理過程.(來源及作者:中國科學院地球化學研究所環(huán)境地球化學國家重點實驗室 陳京晶、張國平、李海霞、付志平、歐陽小雪、吳瓊)


