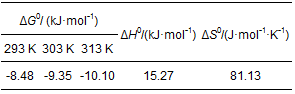1 引言 (Introduction)
鈾礦冶生產中產生了大量的低濃度含鈾廢水, 如不妥善處理直接排放, 對生態環境和人體健康將構成潛在的嚴重威脅, 有效處理含鈾廢水顯得尤為重要 .含鈾廢水的主要處理方法有化學沉淀法、生物修復法、膜分離法和吸附法等, 其中吸附法因其高效廉價、操作簡單、無二次污染且便于鈾回收利用的優點而備受關注, 成為鈾礦冶環境治理的研究熱點.
氧化石墨烯 (GO) 是石墨氧化的產物, 表面富含羧基、羥基等含氧基團, 且比表面積較大, 對重金屬離子有很好的吸附效果研究發現氧化石墨烯對U (Ⅵ) 的最大吸附量達111.7 mg·g-1, 明顯高于其它鈾酰離子吸附劑.但由于氧化石墨烯具有親水性, 吸附后難以從水中分離, 在實際應用中可將GO與其它吸附材料復合, 既可以提高GO的吸附能力, 又使其便于分離回收.殼聚糖 (CS) 是甲殼素脫乙酰化的產物, 其分子結構中存在大量的氨基和羥基, 具有吸附性能好、易再生和價廉等優點.但CS能溶于酸性溶液, 這極大地限制了它的應用, 因此有必要對CS進行交聯改性, 使直鏈的CS分子形成網狀結構, 從而提高其在酸性溶液中的穩定性.有研究表明, 將殼聚糖接枝到氧化石墨烯上得到的CS/GO復合材料熱穩定性高、機械性能好, 對Au3+, Pd2+等有毒重金屬具有良好的吸附效果.但有關CS/GO吸附熱力學、動力學及機理等方面的研究還不夠深入, 且將其應用于低濃度含鈾廢水處理的報道相對較少.本研究利用Hummers法合成氧化石墨烯并與殼聚糖進行混合, 經戊二醛交聯改性后制備出吸附位點多, 不溶于酸, 且可過濾分離的CS/GO復合材料.探討了CS/GO對U (Ⅵ) 的吸附特性, 通過SEM-EDS、FTIR、XRD等表征手段研究其吸附機理, 以期為CS/GO處理含鈾廢水提供理論依據.
2 材料與方法 (Materials and methods) 2.1 主要試劑與儀器
主要試劑:天然鱗片石墨 (325目), 青島金日來石墨有限公司;殼聚糖 (脫乙酰度大于90%), 國藥集團化學試劑有限公司;硝酸鈉、高錳酸鉀、氫氧化鈉、鹽酸 (37%)、戊二醛等其他試劑均為市售分析純, 模擬含鈾廢水采用U3O8(分析純) 根據GBW04201配制而成.
主要儀器:臺式恒溫振蕩器 (IS-RDD3, 美國精騏有限公司);pHS-3C型精密酸度計 (上海雷磁儀器廠);掃描電子顯微鏡 (JSM-7500F, 日本電子);X射線能譜儀 (Energy 350, 英國牛津儀器有限公司);傅里葉變換紅外光譜儀 (NICOLET6700, 美國Themo Fisher公司);X射線衍射儀 (D8 Advance, 德國布魯克AXS公司);紫外可見分光光度計 (T6, 北京普析通用公司).
2.2 殼聚糖/氧化石墨烯的制備
采用改進的Hummers法制備氧化石墨.稱取一定量研磨好的氧化石墨加到25 mL體積分數為1%的乙酸水溶液中, 室溫下超聲45 min, 形成均勻懸濁液.不斷攪拌的同時逐步加入0.5 g殼聚糖粉末, 超聲1 h, 使殼聚糖與氧化石墨烯混合均勻, 再加入1.5 mL 50%的戊二醛作為交聯劑, 繼續攪拌1 h.靜置12 h, 將分散良好的懸濁液用0.1 mol·L-1的NaOH溶液浸泡, 使復合物變成凝膠狀, 將產物過濾并依次用50%的乙醇溶液和超純水洗滌、烘干、研磨、過篩 (0.15 mm), 密封干燥備用.
2.3 吸附試驗
取50 mL一定濃度 (2~100 mg·L-1) 的鈾溶液置于150 mL錐形瓶中, 用0.1 mol·L-1的HCl和NaOH溶液調節pH值 (2~8), 加入適量 (0.05~0.40 g·L-1) 吸附劑, 恒溫振蕩 (20~40 ℃, 150 r·min-1) 一定時間 (5~420 min) 后過濾, 用紫外分光光度計在578 nm處測定濾液U (Ⅵ) 濃度, 試驗重復3次, 取平均值.分別按式 (1) 和式 (2) 計算CS/GO的吸附量q(mg·g-1) 和U (Ⅵ) 的吸附率η:
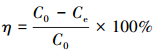
式中:C0、Ce分別為吸附前后溶液中U (Ⅵ) 的濃度 (mg·L-1);V為溶液體積 (L);m為吸附劑的投加量 (g).
2.4 解吸試驗
將0.4 g·L-1的CS/GO投加到pH=5, U (Ⅵ) 初始濃度為150 mg·L-1的溶液中, 30 ℃恒溫振蕩5 h后過濾, 測定濾液中U (Ⅵ) 的剩余濃度.再將吸附后的CS/GO放入100 mL 0.1 mol·L-1的HCl溶液中, 振蕩解吸120 min, 過濾并測定濾液U (Ⅵ) 濃度.將解吸后的CS/GO用去離子水反復洗滌若干次, 烘干后再在相同條件下進行吸附-解吸試驗, 循環利用4次.U (Ⅵ) 的解吸率按照式 (3) 計算:
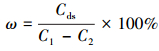
式中:C1為U (Ⅵ) 的初始濃度 (mg·L-1);C2為吸附后溶液中的U (Ⅵ) 濃度 (mg·L-1);Cds為解吸液中U (Ⅵ) 的濃度 (mg·L-1).吸附和解吸過程中溶液的體積相同.
3 結果與討論 (Results and discussion) 3.1 GO含量對CS/GO吸附U (Ⅵ) 的影響
在pH值為5, CS/GO投加量為0.2 g·L-1, U (Ⅵ) 初始濃度為10 mg·L-1, 溫度為30 ℃, 吸附時間為5 h的條件下, CS/GO中GO的質量分數 (5%~70%) 對吸附效果的影響如圖 1所示.
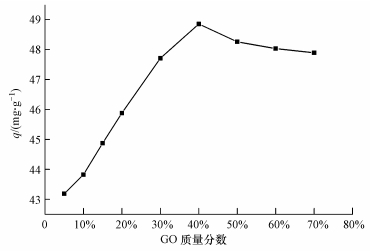
圖 1 GO含量對CS/GO吸附U (Ⅵ) 的影響
由圖 1可見, CS/GO對U (Ⅵ) 的吸附量隨GO含量的提高先快速增加后逐漸減小.這是因為GO的加入增大了CS/GO的比表面積, 提供更多的含氧基團 (羥基、羧基等), 使得CS/GO的吸附能力增強.當GO質量分數為40%時, 吸附量達到最大值.但繼續提高GO含量, 吸附量反而略有降低, 可能是GO上的羧基和CS的氨基發生酰胺化反應, 形成—NHCO—鍵, 從而降低了羧基和氨基對鈾酰離子的螯合能力 (He et al., 2011).在后續試驗中, 均采用GO質量分數為40%的CS/GO復合材料進行吸附試驗.
3.2 pH值對CS/GO吸附U (Ⅵ) 的影響
在U (Ⅵ) 初始濃度為10 mg·L-1, 吸附劑投加量為0.2 g·L-1, 溫度為30 ℃, 吸附時間為5 h的條件下, pH值對GO、CS、CS/GO吸附效果的影響如圖 2所示.
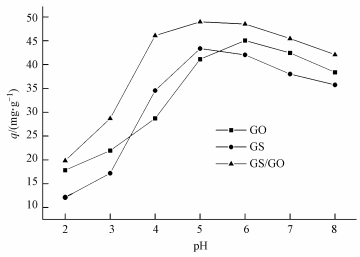
圖 2 pH值對U (Ⅵ) 吸附的影響
從圖 2可以看出, CS/GO對U (Ⅵ) 的吸附量明顯高于CS和GO, pH值對3種材料吸附效果的影響均較大.當pH<5時, 隨著pH值的升高, 吸附量逐漸增大.因為pH值較低時, 溶液中大量的H+與UO22+競爭吸附劑上的結合位點, 同時CS和GO表面的活性基團易被質子化而帶正電, 增強了CS/GO對UO22+的靜電斥力, 故吸附量較低 (鄭偉娜等, 2011).隨著pH值的升高, CS和GO上游離活性基團 (如—NH2、—COOH等) 的含量逐漸增加, 其絡合能力也隨之提高.當pH為5~6時, 3種材料的吸附量達到最大值.pH>6時, 吸附量反而減小, 這是由于溶液中UO22+易發生水解, 形成UO2(OH)3-、UO2(OH)42-等絡合負離子, 與CS/GO表面活性基團產生靜電斥力作用, 阻礙吸附反應的進行;同時溶液中CO32-、HCO3-離子增多, 易與UO22+形成難以被吸附的碳酸鈾酰絡合物 (Zou et al., 2012).因此CS/GO去除U (Ⅵ) 的最佳pH值選為5.
3.3 投加量對CS/GO吸附U (Ⅵ) 的影響
在pH值為5, U (Ⅵ) 初始濃度為10 mg·L-1, 溫度為30 ℃, 吸附時間為5 h的條件下, CS/GO投加量 (0.05~0.40 g·L-1) 對吸附效果的影響如圖 3所示.
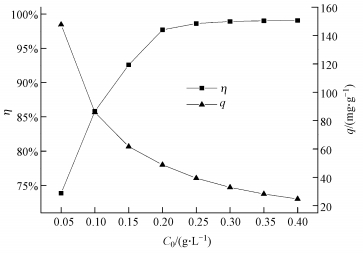
圖 3 CS/GO投加量對U (Ⅵ) 吸附的影響
由圖 3可知, 隨著CS/GO投加量的增加, U (Ⅵ) 的吸附率η逐漸提高, 而吸附量q卻逐漸降低.這可能是用量的增加使得CS/GO上活性位點的數目增多, 鈾酰離子與活性位點結合概率增大, 故U (Ⅵ) 的吸附率隨之上升.當CS/GO投加量較低時, 其表面的氨基、羥基等結合位點能被充分利用, 隨著投加量增加, 吸附劑相互碰撞團聚導致活性基團利用率下降, 從而導致吸附量減小 (陳月芳等, 2013).當CS/GO投加量為0.2 g·L-1時, U (Ⅵ) 的吸附率達97.70%, 繼續增加投加量, 吸附率增加很小.考慮吸附效果且使吸附劑能被充分利用, 試驗中CS/GO的最佳投加量定為0.2 g·L-1.
3.4 反應時間對CS/GO吸附U (Ⅵ) 的影響及動力學分析
在pH值為5, CS/GO投加量為0.2 g·L-1, 溫度為30 ℃的條件下, 反應時間 (5~420 min) 對初始濃度分別為5、10、15 mg·L-1含鈾廢水吸附效果的影響如圖 4所示.
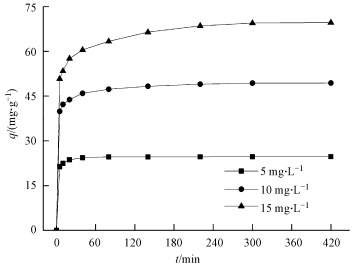
圖 4 反應時間對U (Ⅵ) 吸附的影響
從圖 4可以看出, 在吸附的前5 min, CS/GO對U (Ⅵ) 的吸附量急劇增加, 此后5~300 min吸附量上升減緩, 300 min后吸附趨于平衡.這是由于吸附初期CS/GO上有大量的結合位點, 溶液中UO22+的濃度較高, 使得吸附驅動力較大;而隨著吸附的進行, 有效活性位點被不斷占據, 吸附驅動力減弱, 導致吸附速率變慢.當吸附時間達到300 min后, CS/GO上的活性位點被基本占據, 吸附達到平衡.因此, 確定最佳吸附時間為5 h.
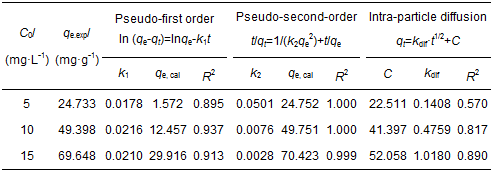
為了探討擴散速率與速率控制步驟對CS/GO吸附過程的影響, 分別采用準一級、準二級動力學模型和顆粒內擴散模型對試驗數據進行擬合, 結果如表 1所示.由表 1可知, 準二級動力學模型中3個濃度的可決系數R2均大于0.999, 且理論平衡吸附量qe, cal接近實際值qe, exp, 說明準二級動力學模型更適合描述CS/GO對U (Ⅵ) 的吸附過程, 由此表明該吸附為化學吸附, U (Ⅵ) 主要通過化學鍵合作用結合在CS/GO表面 (季雪琴等, 2016).另外, 顆粒內擴散模型的擬合直線不經過原點, 表明顆粒內擴散不是CS/GO吸附U (Ⅵ) 的速率控制步驟.
表 1 吸附動力學參數
3.5 吸附等溫線及熱力學分析
在pH值為5, CS/GO投加量為0.15 g·L-1, 溫度分別為20、30、40 ℃, 吸附時間為5 h, U (Ⅵ) 的初始濃度為2、5、10、15、20、30、40、50、70、100 mg·L-1的條件下, CS/GO對U (Ⅵ) 的吸附等溫線如圖 5所示.
圖 5 CS/GO對U (Ⅵ) 的吸附等溫線
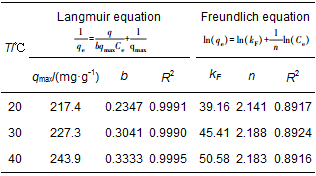
從圖 5可以看出, 隨著平衡濃度的升高, CS/GO對U (Ⅵ) 的吸附量也逐漸增加, 且吸附效果與溫度正相關.采用Langmuir和Freundlich等溫吸附方程對吸附過程進行擬合, 結果如表 2所示.由表 2可知, Langmuir等溫吸附方程的可決系數R2均大于0.999, 而Freundlich等溫吸附方程擬合度較低, 說明CS/GO對U (Ⅵ) 的吸附是單分子層吸附;Freundlich方程中的參數n均大于2, 表明吸附較易 (李凱斌等, 2014);在Langmuir等溫吸附方程中, 初始濃度為10 mg·L-1的鈾溶液在3個溫度下的分離因子RL(表 2 U (Ⅵ) 的等溫吸附方程和擬合參數
利用焓變ΔH0、熵變ΔS0和吉布斯自由能變ΔG0來分析溫度對CS/GO吸附過程的影響, 計算公式如下:
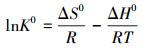
式中:ΔH0(kJ·mol-1) 和ΔS0(J·mol-1·K-1) 可視為不隨溫度改變的常數, 不同溫度的吸附平衡常數K0可按以下方法 (Al-othman et al., 2011) 計算:在不同溫度下分別作lnKd(Kd=qe/Ce) 對Ce的線性圖 (如圖 6), 當Ce趨近于0時即得到該溫度的lnK0.

圖 6 lnKd與Ce的關系線
再根據方程 (5), 通過lnK0對1/T做圖 (圖 7), 由擬合直線的斜率和截距分別計算出ΔH0和ΔS0, 計算結果見表 3.
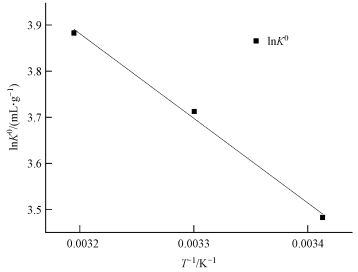
圖 7 lnK0與1/T的關系線
表 3 CS/GO吸附鈾的熱力學參數
由表 3可知, CS/GO對鈾的吸附過程中吉布斯自由能變ΔG0均為負值, 表明吸附反應是自發進行的 (Subbaiah et al., 2011);溫度越高, ΔG0越小, 說明升溫將促進吸附, 這與試驗結論相符;焓變ΔH0>0, 說明吸附是吸熱反應;熵變ΔS0>0, 表明吸附過程中固液交界面的混亂程度增大, CS/GO對鈾酰離子具有一定的親和作用 (王哲等, 2015).
3.6 CS/GO的吸附解吸試驗
通過解吸試驗可以了解吸附劑的循環次數, 以判定其能否重復利用.由前述試驗可知, 在強酸條件下, CS/GO對U (Ⅵ) 的吸附率較低, 因此可通過H+與UO22+之間的離子交換作用來對CS/GO進行洗脫.選用0.1 mol·L-1的HCl溶液作解吸劑, 4次吸附/解吸循環下CS/GO對U (Ⅵ) 的吸附率/解吸率如圖 8所示.
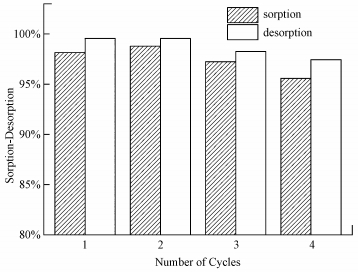
圖 8 U (Ⅵ) 的吸附與解吸
由圖 8可知, 初次解吸率高達99.55%, 解吸一次后吸附率反而略有增加, 這可能是經HCl處理后, CS/GO表面增加了更多的吸附位點.經4次吸附解吸試驗后, CS/GO的吸附率仍高達95%以上, 表明CS/GO具有良好的再生與循環利用性.
3.7 掃描電鏡及EDS能譜分析
圖 9為GO、CS以及CS/GO吸附U (Ⅵ) 前后的掃描電鏡圖.從圖中可以看出, GO呈單層片狀結構, 表面光滑, 局部地方出現彎曲和褶皺;CS表面致密均勻, 沒有明顯的凸起和孔隙;而CS/GO表面粗糙, 凹凸不平, CS與GO結合較為緊密, 材料具有更多的吸附位點和更大的比表面積, 有利于其對鈾酰離子的吸附.對比圖 9c、d可知, 吸附U (Ⅵ) 后CS/GO的形態結構發生明顯變化, 表面變得較平整, 孔隙減少, 這可能是鈾酰離子與CS/GO中的有機官能團相互鍵合的結果 (聶小琴等, 2013).

圖 9 GO (a)、CS (b) 和CS/GO吸附U (Ⅵ) 前 (c)、后 (d) 的掃描電子顯微鏡圖
CS/GO吸附U (Ⅵ) 前后的EDS分析結果如圖 10所示.從圖中可以看出, 吸附前后都有C、N、O、Au存在, 其中Au是照射前的噴金處理導致的, 而殼聚糖和氧化石墨烯中含有大量的C、N、O是圖中C、N、O元素含量較高的原因.吸附后材料中出現很強的鈾峰, 表明CS/GO對U (Ⅵ) 具有一定的吸附能力.

圖 10 CS/GO吸附U (Ⅵ) 前 (a)、后 (b) 的X射線能譜分析圖
3.8 傅里葉紅外光譜分析
圖 11為GO、CS以及CS/GO吸附U (Ⅵ) 前后的紅外光譜圖, 由譜線a可知, GO在3428 cm-1處有一個寬強峰, 為—OH的的伸縮振動峰;在1732、1615、1395和1105 cm-1處分別是C=O和C=C的伸縮振動峰、叔羥基的特征峰以及環氧基C—O—C的伸縮振動峰 (Yang et al., 2010).CS紅外光譜圖中3485 cm-1處是—NH2和O—H的伸縮振動重疊峰, 1662 cm-1處則屬于“酰胺Ⅰ帶”上C=O的伸縮振動峰 (Wang et al., 2009).
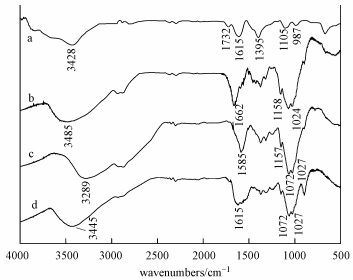
圖 11 GO (a)、CS (b)、CS/GO (c)、CS/GO-U (Ⅵ)(d) 的紅外光譜圖
CS/GO的IR吸收曲線中, 在3289 cm-1處的峰為仲酰胺—NH和—OH相互重疊形成的伸縮振動峰, 該峰相對于CS在3485m-1處的峰出現偏移, 可能是CS上的—NH2與GO的—COOH反應生成酰胺引起的.1585 cm-1處的峰是殼聚糖“酰胺Ⅱ帶”烷基伯酰胺—NH2的彎曲振動峰, 1072 cm-1處是GO上環氧基C—O—C和CS上脂肪伯胺C—NH2的重疊峰, 1157 cm-1和1027 cm-1處的峰則分別來自殼聚糖C6位叔醇基團C6—OH和C3位C3—OH的吸收峰, 上述結果表明CS/GO成功合成.
比較CS/GO吸附前后的FTIR結果可知, CS/GO吸附U (Ⅵ) 后有部分峰位置偏移或者強度發生變化.其中, 3289 cm-1處的峰消失, 在3445 cm-1處出現強度減弱的譜峰, 這可能是由于—OH與U (Ⅵ) 通過氫鍵發生了配位絡合, 而酰胺基N—H未參與反應.1585 cm-1處的峰偏移到了1615 cm-1處, 表明烷基伯酰胺—NH2參與了鈾的螯合.此外, 1072 cm-1和1027 cm-1處的峰強明顯減弱, 說明脂肪伯胺C—NH2和C3—OH基團也參與了U (Ⅵ) 的吸附.以上結果表明, 在CS/GO對U (Ⅵ) 的吸附過程中, 羥基和氨基為主要吸附位點.
3.9 X射線衍射分析
在對CS/GO表面形貌和官能團分析的基礎上, 利用X-射線衍射對其晶體結構進行表征, 如圖 12所示.從圖中可以看出, GO在2θ=10.6°處出現了一個反應GO (100) 晶面的特征峰, 說明石墨已經被充分氧化成GO (吳敏杰, 2011).CS在2θ=20.7°的峰對應于殼聚糖的無定形結構.而復合材料CS/GO在2θ為10.6°和20.7°附近的特征衍射峰強度均明顯減弱, 這可能是GO和CS之間的相互作用影響了CS分子鏈在晶格中的排列, 并導致GO不能相互堆積形成有序結構.
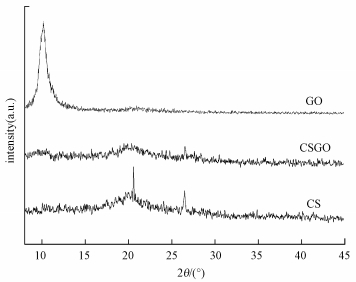
圖 12 GO、CS和CS/GO的XRD圖
4 結論 (Conclusions)
1) 利用Hummers法合成氧化石墨烯 (GO) 并與殼聚糖 (CS) 進行混合, 經戊二醛交聯改性后, 制備得到CS/GO復合材料.
2) CS/GO對U (Ⅵ) 具有良好的吸附性能.當GO質量分數為40%, pH值為5時吸附效果最好, 吸附平衡時間為5 h, 30 ℃時理論飽和吸附量為227.3 mg·g-1.Langmuir等溫吸附方程和準二級動力學模型 (R2>0.999) 能較好地擬合CS/GO對U (Ⅵ) 的吸附過程.CS/GO吸附U (Ⅵ) 是自發的吸熱反應.吸附解吸試驗表明CS/GO具有良好的再生與循環利用性.具體參見污水寶商城資料或http://www.bnynw.com更多相關技術文檔。
3) SEM-EDS、FTIR和XRD分析表明, CS/GO吸附U (Ⅵ) 的過程中, 參與反應的基團主要有羥基和氨基;吸附U (Ⅵ) 后CS/GO表面變得平整光滑, 孔隙明顯減少.