1 引言
依賴于微生物的厭氧消化作用能夠將多種有機廢水和固體廢物轉化為甲烷、氫氣等清潔能源,是一種環境友好型的新能源生產途徑,也是目前處理工農業有機廢物的一個重要手段.厭氧消化的核心是微生物群,因此,獲得高活性的厭氧消化菌群是有效轉化有機廢棄物為能源物質的重要保障.生物反應器內的厭氧消化菌群具有復雜的組成,通常被劃分為3類,即酸化菌群、產氫產乙酸菌群以及產甲烷菌群.其活性受多種因素影響,包括反應器的結構、pH值、水力停留時間等.Nadarajah等認為溫度是厭氧消化菌群的重要影響因子,將影響生物反應器內的菌群結構、化學需氧量(Chemical Oxygen Demand,COD)去除率、出水懸浮固體(Effluent Suspended Solids,ESS)和污泥指數(Sludge Volume Index,SVI)等.
通常厭氧消化作用在2個溫度范圍內進行,即中溫厭氧消化和高溫厭氧消化.良好高溫厭氧消化菌群在馴化之初,菌源常取自于自然環境如土壤、河道底泥、牛羊糞便以及常溫活性污泥等.在提升溫度的富集培養過程中,逐漸形成穩定的厭氧消化菌群.Pettersson等的研究認為,培養溫度改變會給菌群結構的調整帶來新的選擇壓力.溫度轉變幅度越大,這種選擇壓力越強烈,并增加菌群結構調整的幅度.同時,溫度可能影響菌群變化的周轉速率,高的周轉速率使菌群更加快速的更換掉不適應新溫度的菌群.Zheng等利用分子生物學的檢測結果發現,高溫的產甲烷古菌可存在于常溫厭氧反應器中,反之亦然,而其生物量取決于培養溫度.Ahring探索了高溫厭氧消化過程溫度變化對菌群生物量的影響,結果顯示當將一個連續攪拌反應器的培養溫度從55 ℃提高到65 ℃,細菌的生物量將有明顯的下降,而古菌的生物量會有上升,當溫度達到65 ℃時,氫營養型產甲烷古菌具有明顯的生物活性.
可見,溫度的轉變對厭氧消化菌群結構和功能都有強烈的影響.為了減少溫度對厭氧消化菌群的沖擊,在厭氧生物反應器啟動時通常采用梯度升溫的方法(韓育宏等,2009).本研究則利用37 ℃的中溫厭氧消化菌群直接轉入50 ℃培養,并通過連續進料糖蜜有機廢水馴化高溫厭氧消化菌群,進而考察高溫馴化過程中菌群結構、多樣性及功能的變化特征.研究結果對闡明厭氧發酵菌群在溫度劇烈變化帶來的選擇壓力下菌群結構與功能的變化趨勢,對改進高溫厭氧消化菌群富集方法具有重要意義.
2 材料與方法
2.1 厭氧反應器運行條件
400 mL實驗室培養的中溫(37 ℃)厭氧消化秸稈、豬、牛糞便的活性污泥注入1 L自制厭氧反應器中,自來水補充至800 mL,放置于50 ℃條件下培養.高濃度糖蜜有機廢水(100000 mg·L-1 COD)(李杰等,2011)作為厭氧消化原料,每2 d進料1次,每次30 mL(水力停留時間(Hydraulic Retention Time,HRT)=27 d).每次進料前從反應裝置中抽出30 mL厭氧消化液,用于理化指標與微生物多樣性分析,以及維持反應體系體積平衡,厭氧反應器裝置見圖 1.
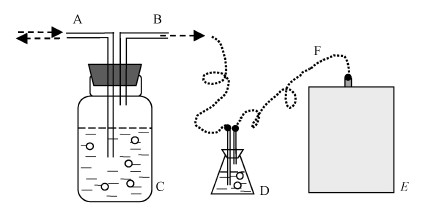
圖 1厭氧消化反應器(A:進/取料口, B:出氣口, C:厭氧發酵瓶, D:緩沖裝置, E:集氣袋, F:連接管)
2.2 理化指標分析
1)pH 取待測液0.5 mL,用日本HORIBA B-212型微量pH計(Compact pH meter,model B-212,Japan)測定pH值.
2)化學需氧量(COD)0.25 mmol·L-1 K2Cr2O7 溶液與Ag2SO4 溶液(Ag2SO4 /濃H2SO4質量體積比=1/100)按體積比1:3混合,記為溶液A.取2 mL 待測樣品、3 mL 溶液A、少許HgSO4(屏蔽Cl-),加入10 mL 消解管中,在消解儀上消解(150 ℃)2 h.消解的樣品冷卻后利用分光光度計測定樣品OD值.空白控制使用蒸餾水替代樣品溶液.
3)沼氣總量及甲烷含量 每日生產沼氣使用集氣袋收集,利用排水集氣法測定總量.沼氣中甲烷含量用英國Geotech 公司的沼氣成分測定儀(型號為Biogas Check)測定.
4)總固體(Total Solids,TS)含量和揮發性固體(Volatile Solid,VS)含量 采用重量法測定.
5)揮發性有機酸(Volatile Fatty Acid,VFA)含量 1 mL消化液10000 r·min-1離心15 min,取0.5 mL上清,加入0.5 mL乙氰,充分混勻后,冰上保持10 min,10000 r·min-1離心15 min后過0.22 μm去除蛋白.前處理樣品檢測有機酸,使用LC/MS-2010A高效液相色譜(Shimadzu,Kyoto,Japan).檢測條件為:10 μL樣品注入儀器檢測,檢測柱為Aminex HPX-87H Column(Bio-Rad,CA,USA),0.05 mmol·L-1 H2SO4為流動相.洗脫程序為0.6 mL·min-1 5 min,0.4 mL·min-1 30 min,0.6 mL·min-1 5 min.柱溫40 ℃,檢測器為二極管陣列檢測器.
2.3 微生物多樣性分析
1)DNA提取及PCR條件 冰凍保存樣品利用淤泥基因組DNA快速提取試劑盒(BioTeke,百泰克生物技術有限公司,北京)提取總DNA,方法按說明.抽提的總DNA利用引物進行擴增,反應體系(50 μL):模板DNA 10 ng,10 ×PCR Gold Buffer 5 μL,25 mmol·L-1 MgCl2,3 μL,dNTP mix(各2 mmol·L-1)5 μL,45 μmol·L-1 引物(27f和906r)各0. 5 μL,5 Unit Ampli Taq Gold 0. 2 μL.PCR反應條件為:94 ℃預變性10 min,94 ℃變性30 s,52 ℃退火45 s,72 ℃延伸1 min 30 s,共22個循環,最后在72 ℃下延伸5 min.PCR產物用15 mg·mL-1的瓊脂糖凝膠電泳檢測.
2)變性梯度凝膠電泳(DGGE)提取厭氧消化菌群DNA,利用PCR儀擴增菌群16S rDNA基因片段片段(使用引物,細菌:357F-GC,517 R;古菌:A348IF,U806IR-GC).使用DcodeTM Universal Mutation Detector System(BIO-RAD Laboratories,Hercules,CA,USA)對所獲DNA片段進行凝膠電泳.變性膠1 mm 厚,Polyacrylamide濃度梯度6%~12%(W/V),0.5× TAB Electrophoresis Buffer(20 mmol·L-1 Tris-HCl,pH值 8.3,10 mmol·L-1 acetic acid,0.5 mmol·L-1 EDTA),變性劑尿素梯度20%~55%(含有40%甲酰胺,7 mol·L-1尿素).電泳電壓200 V,溫度為61 ℃,時間5 h.電泳結束后用SYBR Green I(Molecular Probes,Eugene,OR.)染色,觀察和照相使用Alpha Innotech凝膠成像儀.根據電泳條帶,分析菌群結構穩定性.
3)克隆文庫 將純化后的PCR產物(使用引物,細菌:27F,907R;古菌:109F,912R)連接到pGEM-T Easy載體,4 ℃過夜,然后通過在42 ℃ 熱激 45 s轉化到E.coli JM109菌體內;通過X-Gal和IPTG的α-互補作用篩選出白色菌落.并將白色菌落轉移到新鮮的含有抗生素的LB固體培養基上,編碼建立克隆文庫.利用變性梯度凝膠電泳(Denaturing Gradient Gel Eletrophoresis,DGGE,變性劑濃度范圍設為20%~60%)篩選出不同種類的克隆子.對含有目標克隆子的菌體,用堿裂解法提取質粒,并測序.利用GenBank(NCBI,進行相似菌株檢索,獲取近緣菌株相關序列.應用DNA序列分析軟件DNA Star 7.0和MEGA 5.0軟件進行序列拼接,構建系統發育樹(NJ法).
4)定量PCR 古菌總量定量PCR采用Platinum ® SYBR ® Green qPCR SuperMIx-UDG試劑盒.反應體系(20μL)為:2×Platinum SYBR ® Green qPCR SuperMix-UDG,10 μL;50 mmol·L-1 MgCl2,1.2 μL;Forward and Reverse specific primers(10 pmol·μL-1),各0.4 μL;DNA,1 μL;Rox,0.4 μL;PCR grade distilled water 7.8 μL.標準曲線制作,使用含有被檢測菌株目標片段克隆子的pGEM-T Easy質粒作為標準樣品,用熒光定量儀精確測定標準樣品濃度,并計算其拷貝數.將稀釋成不同數量級拷貝數的梯度標準液,與被測樣品一同使用ABI Prism ® 7500型熒光定量PCR儀(ABI,USA)進行PCR及熒光檢測.擴增程序采用ABI儀器的標準程序:50 ℃持續 2 min(UDG孵育)→ 95 ℃持續2 min → 40個循環:95 ℃,15 s;60 ℃,30 s.熒光檢測器在60 ℃時測定體系熒光強度.數據分析,通過Ct值確定標準曲線,評價數值的優良,最終獲取待測樣品拷貝數(生物量).Methanomicrobiales(MMB),Methanococcales(MCC),Methanosaetaceae(MST)分析使用TaqMan ® Universal PCR Master Mix(Applied Biosystems,USA)試劑盒分析,反應體系為PCR-grade water,5 μL;Forward and ,各1 μL;對應TaqMan探針(1 μmol·L-1)1 uL;2×TaqMan ® Universal PCR Master Mix,10 μL; DNA,1 μL.其他同Platinum ® SYBR ® Green qPCR SuperMIx-UDG試劑盒反應.其中MMB退火溫度為63 ℃.
3 結果
3.1 高溫馴化過程中COD、pH值和菌群產沼氣量、甲烷含量變化
將來自于實驗室的37 ℃條件下運行的禽畜糞便厭氧消化產甲烷菌群直接轉移至50 ℃條件下培養,處理高濃度有機廢水.高溫馴化期間,厭氧消化菌群的產氣量、甲烷含量、pH值及COD等理化特征指標被檢測(圖 2).結果表明中溫的厭氧產甲烷菌群轉入高溫培養的前7 d即開始產氣,平均日產氣量為115 mL·d-1,20 d后,產氣量進入高峰期,平均日產氣量超過360 mL·d-1.最高日產氣量出現在培養的第31 d,達到410 mL·d-1(圖 2d).培養期間總計產氣量為9735 mL(圖 2d),平均COD轉化效率為162.5 mL·g-1.甲烷含量的變化趨勢與平均日產氣量相似,初期甲烷含量較低(18.9%),20 d后,甲烷含量維持在34%以上.反應器內的COD含量在產氣期間穩定在6800~7700 mg·L-1(圖 2a),pH值維持在7.3~8.1之間(圖 2b).4個參數的檢測結果表明厭氧消化菌群被轉至高溫條件下馴化培養,能夠快速啟動,并連續、穩定地處理高濃度有機廢水產生沼氣.
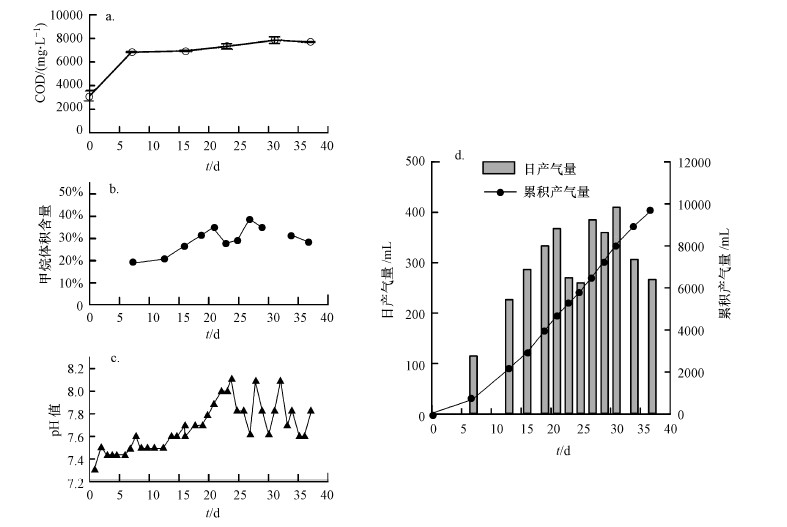
圖 2高溫馴化厭氧消化菌過程中COD、pH值和菌群產沼氣量、甲烷含量變化(注:本研究中0 d樣品為30 ℃培養的原始厭氧消化液,其他時間為轉移至50 ℃后的厭氧消化液樣品,下同.)
3.2 高溫馴化厭氧消化菌群過程中有機酸含量變化
丙酸和乙酸是發酵液中含量最高的兩類有機酸(圖 3).丙酸含量在啟動前期占有明顯的優勢,最高值為784.7 mg·L-1(第15 d),當反應器運行狀態穩定后,丙酸含量顯著下降,在培養的第30 d,降低至25.3 mg·L-1.乙酸是產甲烷古菌合成甲烷的重要底物,反應器內乙酸的積累及轉化速度常常反應了厭氧消化菌群生產甲烷的狀態.在反應器啟動前期,發酵液內出現乙酸積累現象,并隨培養時間的增加而增加,在第15 d含量達到439.3 mg·L-1.進入產氣高峰后,反應體系內的乙酸含量明顯降低,在培養的第30 d,乙酸含量減少至145.3 mg·L-1.甲酸和乳酸在發酵液中的含量較少,其中乳酸質量濃度18~81 mg·L-1之間,甲酸僅在發酵前期被檢測到,質量濃度約在16~18 mg·L-1之間.
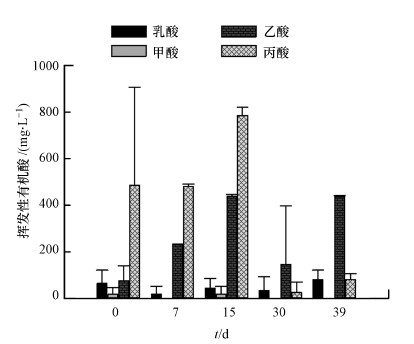
圖 3厭氧消化過程有機酸含量變化
3.3 高溫馴化厭氧消化菌群過程中菌群結構分析
反應器運行期間,厭氧消化菌群中細菌和古菌的菌群結構利用DGGE技術進行分析.結果顯示,在細菌菌群的DGGE圖譜中,大量的高亮條帶存在于每個泳道內,表明細菌菌群的多樣性十分豐富(圖 4a、4b),而古菌菌群的高亮條帶相對于細菌菌群明顯減少.在反應器運行期間,無論細菌還是古菌菌群,都存在一些條帶的消失和出現的狀況.在細菌菌群中約有7個主要條帶出現(“△”指示部分,下同),7個主要條帶消失(“![]() ”指示部分,下同);古菌菌群中約有9個主要條帶出現,4個主要條帶消失.表明,轉變培養溫度后,細菌和古菌的菌群結構均出現明顯變化,菌群內微生物的生物量和種類呈現大幅的調整,以適應新的溫度條件.
”指示部分,下同);古菌菌群中約有9個主要條帶出現,4個主要條帶消失.表明,轉變培養溫度后,細菌和古菌的菌群結構均出現明顯變化,菌群內微生物的生物量和種類呈現大幅的調整,以適應新的溫度條件.
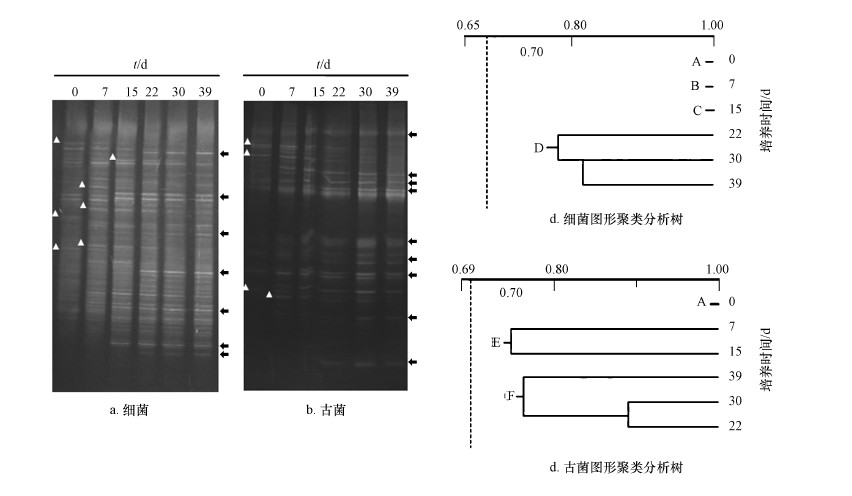
圖 4 DGGE技術分析細菌和古菌的菌群結構(注:a. 細菌不同培養時間的DGGE圖像;b. 古菌不同培養時間的DGGE圖像,“△”指示新增條帶,“ ![]() ”指示消失條帶;c. 細菌DGGE圖像的聚類分析;d. 古菌DGGE圖像的聚類分析,采用Quantity One 4.3軟件UPGMA分析.)
”指示消失條帶;c. 細菌DGGE圖像的聚類分析;d. 古菌DGGE圖像的聚類分析,采用Quantity One 4.3軟件UPGMA分析.)
利用Quantity One軟件對反應器菌群DGGE圖片中的條帶圖形進行分析,所獲數據利用UPGAMA方法進行聚類分析繪制成系統樹,結果見圖 4c.細菌菌群的DGGE圖譜被劃分入4個族,0、7、15 d圖譜分別屬于A、B、C 3個族,22、30、39 d圖譜被劃歸入D族,表明在轉入高溫培養的前22 d,發酵體系內的菌群結構不斷調整,以適應新溫度帶來的選擇壓力.22 d后,菌群結構趨于穩定.古菌菌群的DGGE圖譜被劃歸入3個族(圖 4d),0 d譜圖劃歸為A族,7 d和15 d圖譜劃歸入B族,22、30和39 d圖譜劃歸入C族.表明改變溫度培養后,古菌菌群結構即產生變化.菌群結構的變化程度弱于細菌,且變化主要集中在培養的前7 d.與細菌相似,古菌菌群結構自22 d后進入穩定階段,直至培養結束,菌群結構沒有出現顯著的差異.通過細菌和古菌DGGE圖譜變異分析結果,可發現,中溫厭氧消化菌群轉入高溫培養后,菌群結構將會發生顯著的變異,這種菌群結構的變異將會持續20 d左右,這與反應體系沼氣產量相吻合(圖 2d).細菌的變遷程度相對于古菌更加劇烈,導致這一現象的原因可能是由于細菌菌群的多樣性較古菌菌群更為豐富所引起的.這一分析結果可由針對DGGE圖譜的主成分分析更為形象的說明(圖 5).
圖 5(Fig. 5)
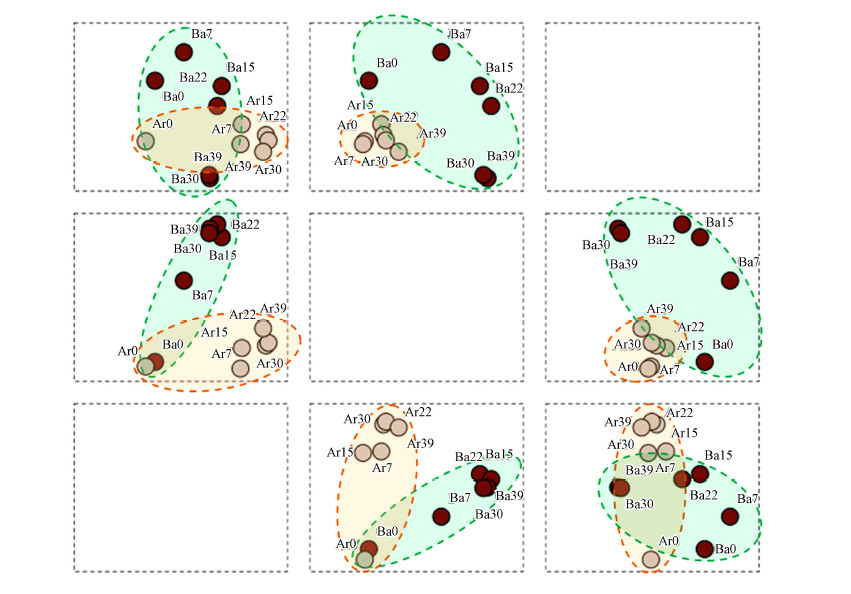
圖 5細菌和古菌DEEG條帶變化的主成分分析(注:圖中Ba為細菌,Ar為古菌,數值為培養時間)
主成分分析常用來分析菌群結構變化.在本研究中,細菌和古菌菌群的分析結果被提取了3個主成分,其累積方差為73.2%(主成分1、2、3分別為32.1%、28.1%、13.0%).圖 5為3個主成分的載荷圖,元素類型矩陣.圖中結果顯示,細菌菌群和古菌群在圖中能夠較為明顯的被區分.與古菌菌群相比,細菌菌群在轉變培養溫度后菌群結構方差值更為分散,表明細菌菌群的結構變異更為強烈.轉入高溫培養后,2組菌群的菌群結構與原始培養溫度均產生了明顯的變化,在圖中則表現為0 d的菌菌群結構和后期培養的菌群結構均產生了較遠的變異距離.
3.4 高溫馴化厭氧消化菌群過程中菌群多樣性分析
厭氧消化菌群的16S rRNA基因片段利用克隆方法被獲取,并建立克隆文庫、繪制系統發育樹,獲取菌群內菌群多樣性信息.
圖 6a顯示厭氧消化菌群中細菌菌群的系統發育特征.所有細菌菌群劃入7個族,包括Caloramator、Thermoanaerobacter、Peptococcaceae、Thermacetogenium、Acetomicrobium、Soehngenia、Bacteroides.其中Ba4族主要為Thermacetogenium菌,在菌群中的比例最多,達到33.44%.第4族中的類似菌株Thermacetogenium phaeum strain PB.分離于55 ℃高溫的厭氧反應器,能夠與嗜熱氫營養型產甲烷菌共生而氧化乙酸.Bac5在細菌菌群中的比例約為20.99%.此族的已知代表菌株為Acetomicrobium faecal,該菌發現于下水道污泥,它能夠代謝多種己糖和戊糖為乳酸、乙酸、乙醇、CO2等.此外,Bac3、Bac1、Bac7等族的菌株在厭氧消化菌群中占有較大比例,分別為13.5%、12.35%、12.34%.它們多數發現于高溫厭氧環境.
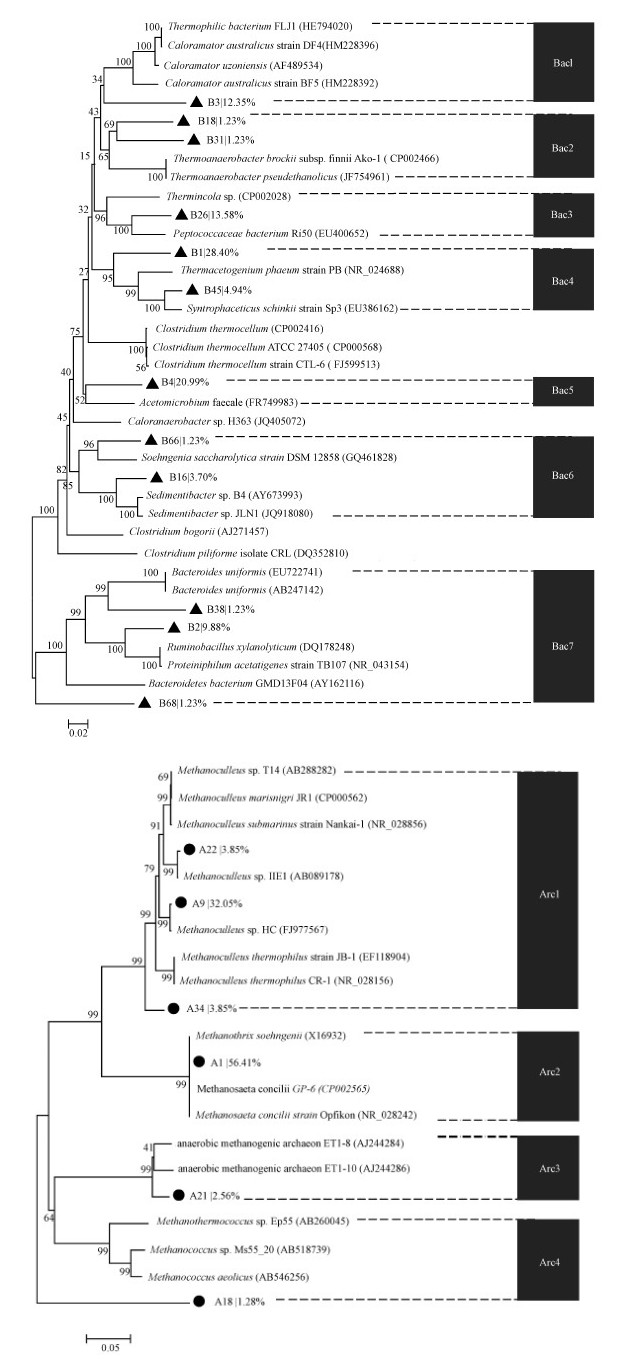
圖 6細菌、古菌菌群16S rDNA序列的系統發育樹分析
厭氧消化菌群中的古菌菌群被劃分為4個族(圖 6b),其中Arc2為4族中最為豐富的古菌菌群,豐度為檢測古菌總量的56.4%,代表菌株Methanosaeta concili是一類能夠利用乙酸作為唯一能源底物代謝產生等量的CH4和CO2.能夠利用甲酸、乙酸和CO2作為碳源而生長.Arc1在古菌clone文庫中所占的比例為39.75%,代表菌株為Methanoculleus,該菌株能夠利用H2/CO2作為底物而生長并產生甲烷.一些菌種還需要乙酸作為生長因子.此外,還有一些厭氧產甲烷古菌及Methanococcus(Arc3和Arc4)被檢測到,它們在clone文庫中的比例分別為2.56%和1.28%.Jones的研究發現Methanococcus是一種產甲烷古菌,能夠利用H2和CO2生成甲烷.Arc3中的近緣古菌為Chin所報道,是通過克隆文庫方法于水田土壤中發現的菌株.
可見,轉入高溫培養后,菌群中主要的構成菌株轉換成為能夠在高溫條件下生長并與糖、多種有機酸代謝相關的細菌菌株以及產甲烷古菌菌株.正是由于這些菌株的穩定存在,才能夠維持菌群在高溫條件下穩定消化有機廢水生成沼氣.
3.5 高溫馴化厭氧消化菌群過程中主要菌株的定量分析
產甲烷古菌的總生物量及一些典型的產甲烷古菌的生物量可以利用熒光定量PCR方法進行定量分析.結果顯示,厭氧消化菌群從37 ℃轉移至50 ℃,產甲烷古菌的總生物量減少(圖 7c),并在22 d后進入相對穩定狀態,含量約為7.6×106 拷貝/g活性污泥,相比于中溫培養減少42.2%.利用特異性熒光探針,檢測了MMB,MCC,MST 3類產甲烷古菌,發現,MMB是一類在37 ℃和50 ℃均能檢測到,并大量存在的產甲烷古菌類群,這與董慧峪等(2014)的研究結果相一致.MCC和MST的生物量在群體中
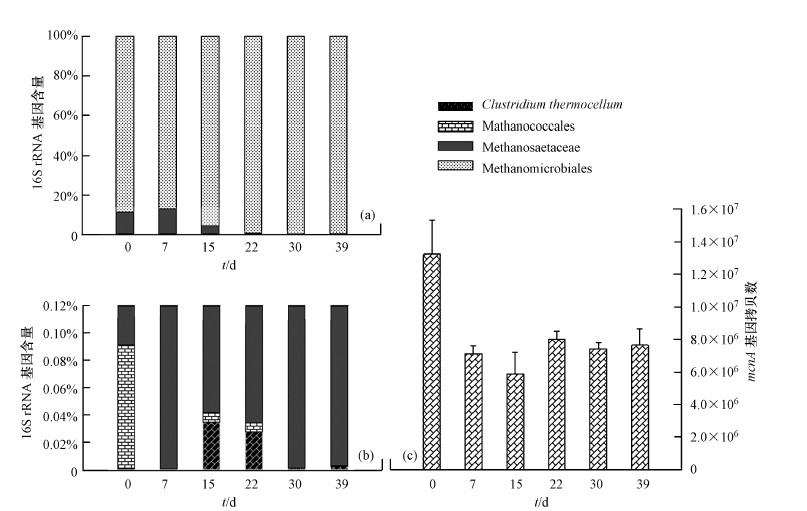
圖 7厭氧消化菌群內產甲烷古菌的生物量(注:(a).各類菌株的16S rRNA基因拷貝數占被檢測總菌株拷貝數的比例;(b),(a)放大到0.12%(Y軸)尺度的圖像;(c).產甲烷古菌mcrA基因的拷貝數)
較少約占檢測4種菌株總量的11%,并且在轉入高溫培養后,其生物量的急劇減少,MCC甚至在菌群穩定后消失.表明這2種產甲烷古菌并不適宜于50 ℃條件下生長.Clostridium thermocellum是一株嚴格厭氧的纖維素分解菌株,廣泛存在于含有纖維素基質的厭氧降解環境.C. thermocellum 是一株能夠在高溫良好生長的菌株,在本文中,轉入高溫后生物量反而小于常溫培養,推測為厭氧消化體系以不含纖維素糖蜜廢水為主,因缺乏適宜的代謝底物,隨著厭氧消化體系運行時間的延長,生物量逐漸衰退.
4 討論
在厭氧消化過程,溫度通常是影響微生物菌群的顯著因子,影響微生物的生長和生存.本研究將37 ℃的厭氧消化菌群直接提溫至50 ℃馴化培養,在溫度和底物的選擇壓力下,原始菌群結構經過劇烈的變化調整后逐漸適應新的溫度條件,并具有產甲烷的功能.通常在厭氧消化菌群馴化中,多采用中溫菌群梯度升溫的方法獲得高溫厭氧消化菌群,如歐陽二明等等采用序梯度升溫方法將中溫活性污泥(35 ℃)馴化為高溫處理熱水解污泥的菌群.李超偉等以食堂餐廚垃圾為原料,采用中溫沼液作為菌種經緩慢升溫成功啟動了高溫處理餐廚垃圾的厭氧消化裝置.在本研究中通過一步直接提溫的方法也可獲得高溫厭氧消化高濃度有機廢水菌群,這與Ahring、Tian和Raskin的觀點相一致.
一些中溫厭氧消化菌群中常存在適宜于高溫生長的功能菌株,這部分菌株并不會在中溫條件下的長期培養而丟失.無論本研究中將分解禽畜糞便的中溫厭氧消化菌群直接轉入高溫培養,獲得高溫厭氧消化菌群,還是利用梯度升溫法獲得高溫厭氧消化菌群,其結果均能使存在于中溫菌群中的高溫功能菌株活化并富集為優勢菌群而發揮功能.其區別在于菌群在溫度改變過程中所面臨的選擇壓力大小.顯然,直接提升溫度的方法增加了這種選擇壓力.
在菌群結構變遷過程中,細菌的變化程度較古菌強烈.Gobema等研究認為,細菌具有非常高的多樣性,在常溫厭氧反應器內,其種類豐富程度遠高于古菌.本研究中,當培養溫度提高以后,大量DGGE條帶或消失、或新增,表明菌群內一些無法適應新培養溫度菌株的生物量驟減,而適應高溫生長細菌菌株的生物量增加并占據了活躍的主導地位.與細菌菌群相比較,古菌菌群的多樣性變異較為平緩,這除了與古菌種類較少(圖 3、5、6)有關,可能也和古菌生長周期長、生長緩慢有關.細菌因其生長速度快,菌群結構更新周期短,表現為細菌菌群結構變異劇烈.具體參見污水寶商城資料或http://www.bnynw.com更多相關技術文檔。
5 結論
1) 37 ℃培養的中溫厭氧消化產甲烷菌群直接轉入50 ℃高溫馴化處理高濃度糖蜜有機廢水,厭氧消化過程能夠快速啟動并生成甲烷,并在22 d后形成穩定的高溫厭氧消化產甲烷菌群,平均甲烷生成效率為162.5 mL·g-1.穩定產氣期間乙酸和丙酸的質量濃度分別為25.3和145.3 mg·L-1.
2) 菌群結構及多樣性在高溫馴化過程中發生劇烈變化,細菌強于古菌,并逐漸穩定成為以細菌(Thermacetogenium,Acetomicrobium)以及產甲烷古菌(Methanosaeta,Methanoculleus)為主要優勢菌群的高溫厭氧消化菌群.
3) 所獲高溫厭氧消化產甲烷菌群,其產甲烷古菌的總生物量明顯下降,大約為7.6×106拷貝/g活性污泥.


