作為重要的化工原材料,三氯乙烯(trichloroethylene)應用于金屬脫脂、干洗、化工產品原料以及藥品生產加工等過程。盡管企業嚴格控制TCE的使用和處置,但仍存在由于使用管理和廢物排放不當或容器泄露等事件引起土壤和地下水的污染。TCE具有粘度低、水溶性差和密度大等特性,能夠輕易地穿透土壤并遷移至地下水中,在土壤和地下水中長期賦存,進而對環境和人類健康造成持續危害。
近年來,表面活性劑增溶-化學氧化聯合修復技術被廣泛應用于受有機物污染的地下水治理中,其原理主要是將表面活性劑注入污染區域,通過表面活性劑的增溶作用,使有機污染物溶解到水相中,之后在原位或抽出至地面上通過化學氧化去除污染物。當表面活性劑在水溶液中的濃度大于其臨界膠束濃度(criticalmicellarconcentration)時,表面活性劑會形成膠束包裹污染物,發揮其增溶作用。表面活性劑主要分為陰離子、陽離子和非離子型,在實際應用中,非離子表面活性劑吐溫-80(Tween-80)使用頻率較高,因此,本研究選擇TW-80作為表面活性劑的代表。目前在污染地下水化學氧化修復技術中常用的氧化劑主要有過一硫酸鹽(peroxymonosulfate)、過二硫酸鹽(persulfate)和過氧化氫(hydrogenperoxide)等。其中,PMS憑借其不對稱結構和高于PDS和H2O2過氧化物鍵能而展現出更強的氧化能力。在熱、紫外、過渡金屬或堿等活化方式下,PMS能夠生成硫酸根自由基(SO4-·)、羥基自由基(HO·)和超氧自由基(O2-·),進而氧化降解氯代烴和多環芳烴等有機污染物。鐵作為廉價的過渡金屬常被用作活化劑,其中Fe(Ⅱ)能快速活化PMS,產生大量的自由基。但隨著反應的進行,Fe(Ⅱ)不斷被消耗并轉化為Fe(Ⅲ),且以氫氧化物的形式沉淀析出,導致反應體系催化性能下降。為了進一步提高體系氧化效率,需要將Fe(Ⅲ)及時還原為Fe(Ⅱ),促進反應過程中Fe(Ⅱ)/Fe(Ⅲ)循環。因此,本研究使用硫化亞鐵(ferroussulfide)作為催化PMS的手段,其中FeS不僅能夠提供Fe(Ⅱ),而且可以將反應中生成的Fe(Ⅲ)還原為Fe(Ⅱ),反應過程如式(1)~(4)所示。
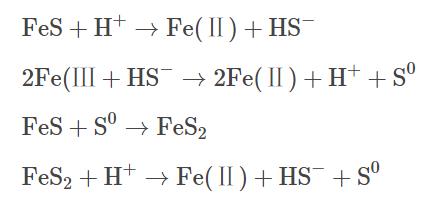
目前為止,關于FeS活化PMS降解含表面活性劑水溶液中TCE的研究尚鮮有報道。本研究選擇PMS作為氧化劑、FeS作為活化劑、TCE作為污染物、TW-80作為表面活性劑,研究了PMS/FeS體系對含有TW-80水溶液中TCE的降解效果,考察了PMS和FeS投加量、溶液初始pH和無機陰離子對PMS/FeS體系中TCE降解效果的影響,探究了PMS/FeS體系在反應過程中產生的自由基種類以及TCE降解的機制,并在實際地下水中驗證PMS/FeS體系對TCE的降解效果,以期為該技術在實際工程中的應用提供參考。
1、材料與方法
1.1 試劑與儀器
實驗試劑包括過硫酸氫鉀、FeS、TCE、TW-80、異丙醇(IPA)、叔丁醇(TBA)、氯化鈉、硝酸鈉、磷酸鈉、碳酸鈉、硫酸、氫氧化鈉、5,5-二甲基-1-氧化吡咯啉(DMPO)、四氯乙烯(perchlorethylene)、1,1,1-三氯乙烷(trichloroethane)、四氯化碳(tetrachloromethane)、1,2-二氯乙烷(dichloroethane)、三氯甲烷(trichloromethane)和二氯甲烷(dichloromethane),以上試劑均為分析純。實際地下水取自上海市松江區地表以下20m的深井。
實驗儀器包括氣相色譜分析儀(7890A,安捷倫科技有限公司)、電子順磁共振儀(EMX-8/2.7C,德國Burker)、離子色譜儀(ICS-1000,美國Dionex)、紫外可見光分光光度計(DR-6000,美國HACH)和pH測定儀(AL204,瑞士Metter-Toledo集團)。
1.2 實驗方法
向250mL定制玻璃反應器中加入預先配制好的13g·L−1TW-80溶液。將一定體積的超純水配制的TCE儲備液加入到反應器中,加超純水至250mL,使TW-80和TCE分別稀釋至1.3g·L−1和0.15mmol·L−1,再依次加入FeS和PMS后開始計時,反應過程中使混合液充分攪拌,在預定時間點取樣分析。分別添加不同濃度的氯化鈉和碳酸氫鈉探究Cl-和HCO3-對降解的影響。實驗中用0.1mol·L−1硫酸或氫氧化鈉調節溶液pH。每組實驗均進行3次,取其平均值。
除探究某物質濃度對實驗結果的影響和實際地下水實驗外,其余條件下PMS、FeS、TW-80和TCE的初始濃度均分別設定為0.8mmol·L−1、0.6g·L−1、1.3g·L−1和0.15mmol·L−1。
淬滅實驗選擇叔丁醇(淬滅HO·)、異丙醇(淬滅HO·和SO4-·)和三氯甲烷(淬滅O2-·)作為淬滅劑。測定TCE降解過程中氯離子的釋放時,在不同時間點采集5mL樣品,加入1mL甲醇終止反應,放置12h揮發掉殘余的TCE,采用離子色譜儀分析氯離子濃度。除實際地下水實驗外,其他實驗均使用超純水。
1.3 分析方法
采用正己烷萃取法測定TCE濃度。取0.2mL反應樣品注入到預先裝有2.8mL正己烷的棕色瓶中,旋渦振蕩5min后再靜置5min,用滴管吸取上層有機相至進樣瓶中密封,使用氣相色譜分析儀分析。溶液中Fe(Ⅱ)和總鐵濃度采用鄰菲啰啉分光光度法測定;PMS濃度采用碘化鉀分光光度法測定;TW-80濃度采用硫氰酸鈷銨顯色-分光光度法測定;氯離子和硫酸根離子濃度通過離子色譜儀測定。
2、結果與討論
2.1 不同反應體系對TCE的降解效果
圖1反映了不同反應體系對TCE的降解效果。其中PMS、FeS、Fe(Ⅱ)、TW-80和TCE的初始濃度分別設定為0.8mmol·L−1、0.6g·L−1、0.6g·L−1、1.3g·L−1和0.15mmol·L−1。空白組中由于揮發導致TCE在60min內減少了5.7%。當只加入PMS時,TCE降解率僅為14.7%,表明在沒有活化劑加入的條件下,PMS的氧化性能沒有得到充分發揮。但當體系中加入Fe(Ⅱ)或FeS后,TCE的降解率由14.7%分別顯著提升到44.7%和90.0%。這表明Fe(Ⅱ)和FeS均能有效活化PMS,產生活性自由基可降解TW-80和TCE(式(5)和式(6))。與Fe(Ⅱ)相比,FeS活化性能更為顯著。當加入Fe(Ⅱ)后,Fe(Ⅱ)在5min內被快速消耗,在之后的反應過程中因Fe(Ⅱ)轉化為Fe(Ⅲ)并以氫氧化物的形式沉淀析出,活化PMS效果急劇下降,最終導致TCE降解停滯;反應60min后,PMS/Fe(Ⅱ)體系中Fe(Ⅱ)和溶解性總鐵濃度分別為0.02mmol·L−1和1.86mmol·L−1。而在TW-80共存的PMS/FeS體系中,因FeS的還原作用,體系中Fe(Ⅱ)與Fe(Ⅲ)不斷循環,TCE降解率在60min內提升至90.0%。當無TW-80存在時,TCE在10min內降解99.4%,表面活性劑的加入略微抑制了TCE的降解。由于TW-80的增溶作用,TCE分子被其包裹,反應中產生的活性自由基在攻擊TCE分子前需先攻擊TW-80分子,因此,導致TCE降解效率有所下降。
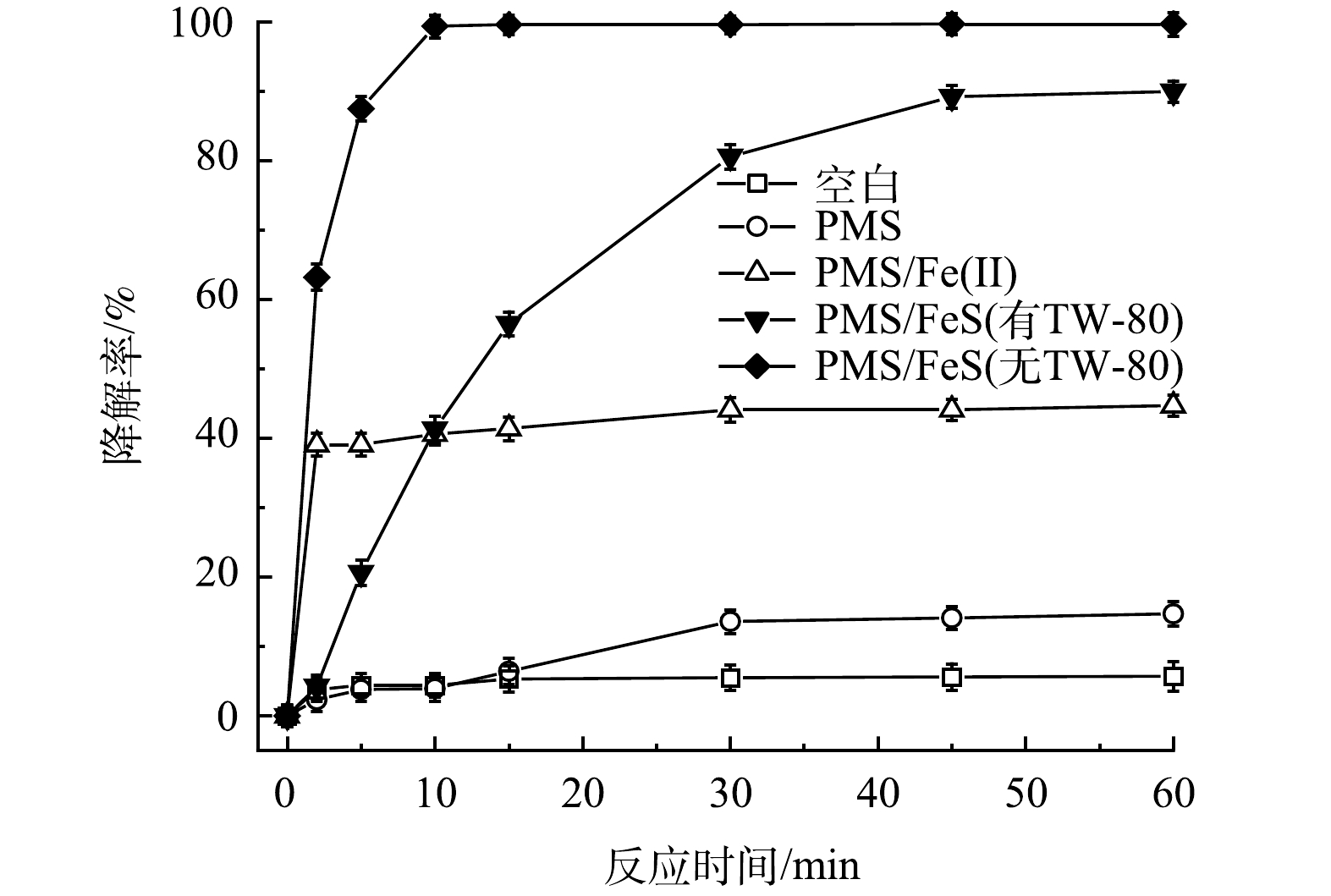
圖1 TCE在不同體系中的降解效果比較
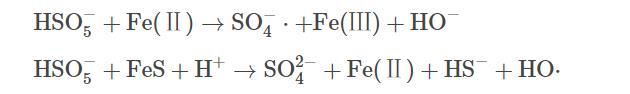
2.2 PMS和FeS投加量對TCE降解效果的影響
控制FeS、TW-80和TCE的初始濃度分別為0.6g·L−1、1.3g·L−1和0.15mmol·L−1,考察PMS投加量對PMS/FeS體系降解TCE的影響。如圖2所示,當不加入PMS時,整個反應過程中TCE降解率僅為5.5%。隨著提高PMS投加量,TCE降解率顯著升高。當PMS濃度為0.2、0.4和0.8mmol·L−1時,反應60min時TCE降解率分別為57.8%、82.1%和93.1%;但進一步增加PMS濃度至1.2mmol·L−1和1.6mmol·L−1時,TCE降解率由93.1%分別下降至90.2%和81.1%,表明提高PMS濃度并不會一直促進TCE的降解。當體系中PMS濃度較高時,產生的活性自由基會與多余的PMS發生反應,生成SO5-·(式(7)和式(8)),而SO5-·的氧化能力(E0=1.10eV)低于SO4−·(E0=2.50-3.10eV)和HO·(E0=2.76eV)。此外,如式(9)和式(10)所示,PMS濃度較高時,體系中產生的高濃度SO4−·和SO5-·也會發生自我消耗。此外,由圖3可見,在TCE的降解過程中,PMS也隨之消耗,在60min內其分解率高達95%。以上結果表明PMS被充分利用。
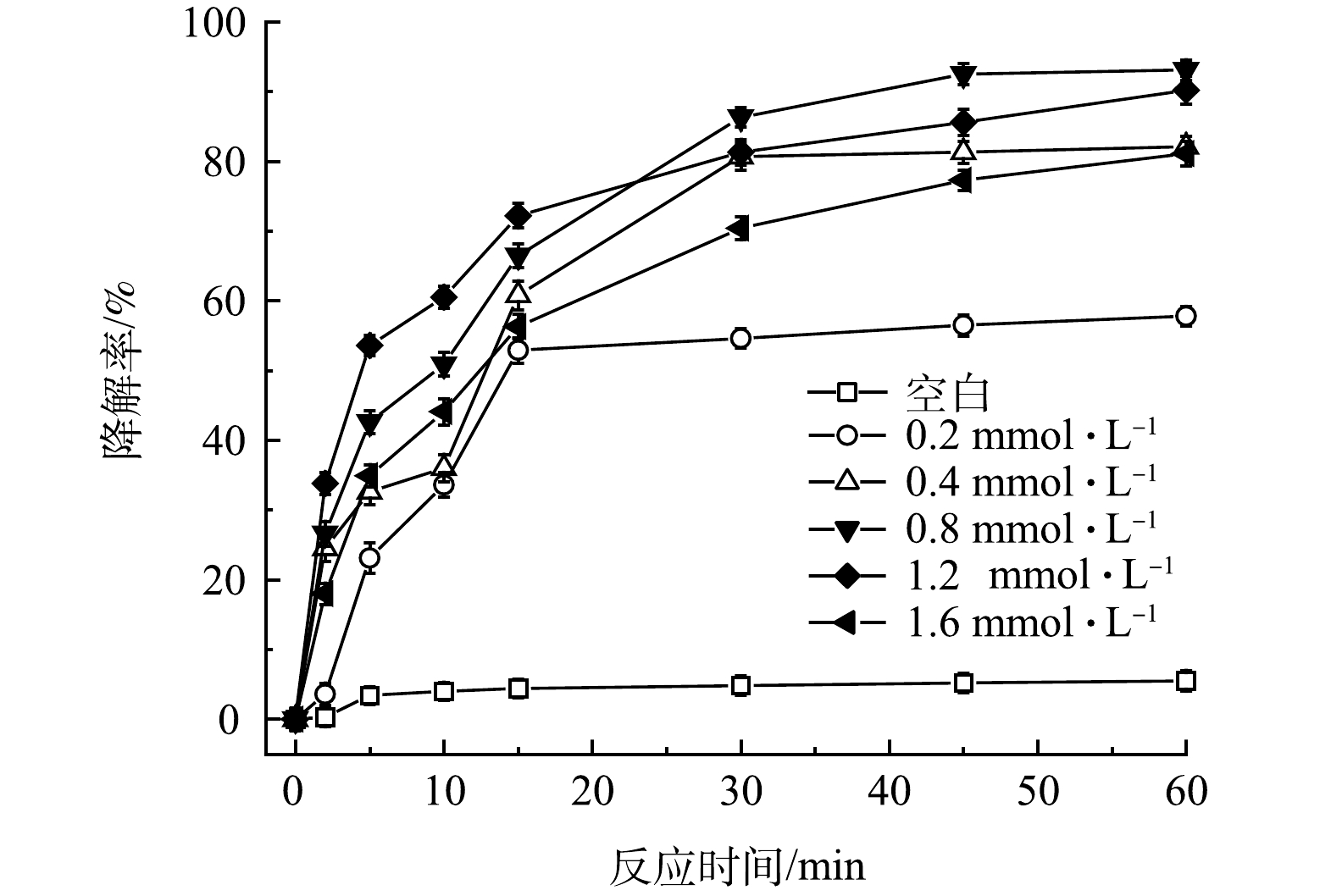
圖2 PMS劑量對TCE降解效果的影響
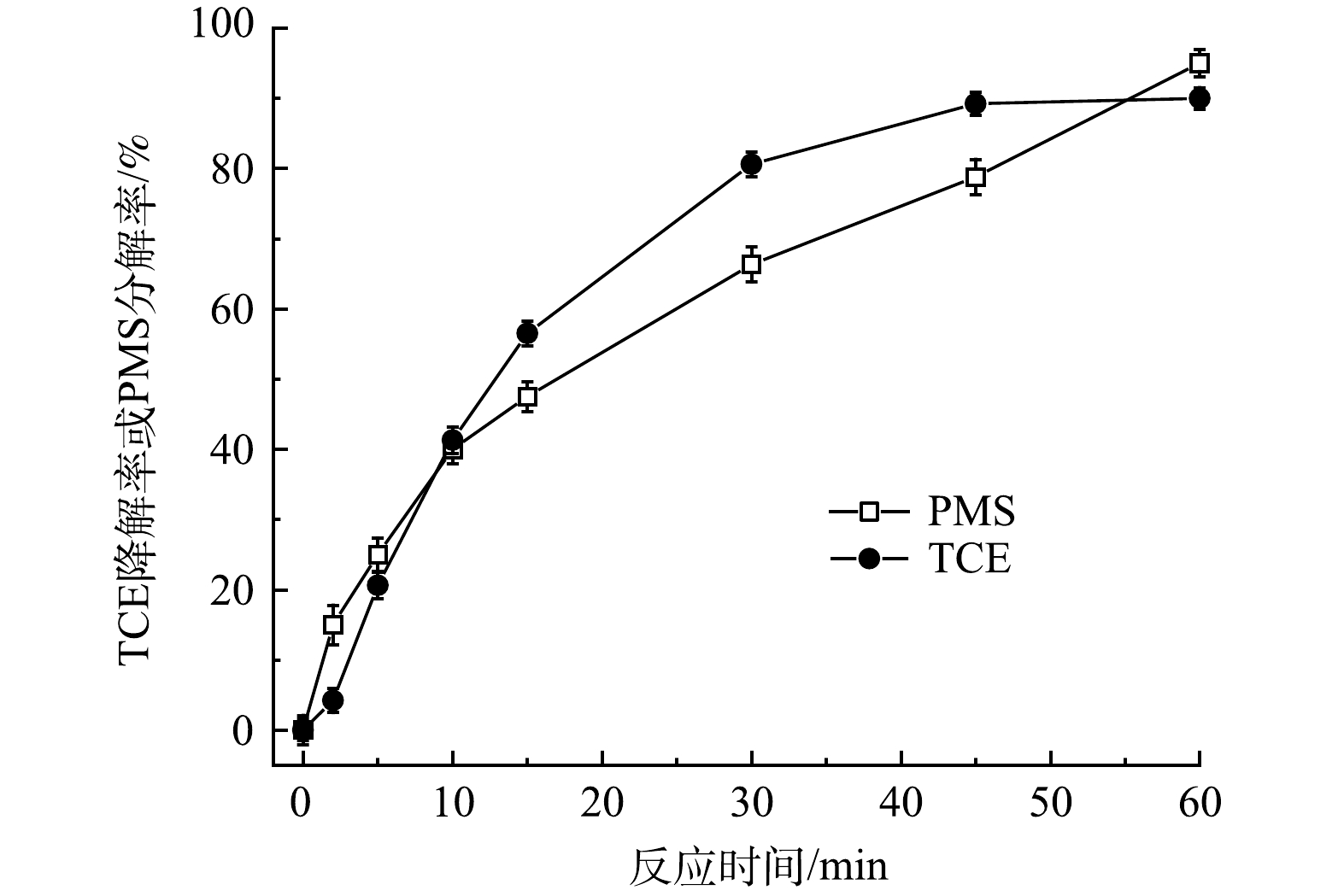
圖3 PMS/FeS體系中TCE降解率與PMS分解率
在相同實驗條件下,考察了FeS投加量對PMS/FeS體系降解TCE的影響。如圖4所示,當不加FeS時,TCE僅降解了14.3%。當FeS為0.3g·L−1和0.6g·L−1時,TCE降解率由14.3%分別上升至53.4%和91.2%。隨著FeS投加量的增加,PMS得到有效活化,TCE降解率也隨之提高。值得注意的是,當FeS投加量增加到0.9、1.2和1.5g·L−1時,TCE降解率分別為92.1%、90.0%和90.1%,與加入0.6g·L−1的FeS劑量對比,TCE的降解效果改變甚微,表明在FeS劑量為0.6g·L−1條件下,PMS被充分活化和消耗,繼續增加FeS劑量不會有效提高TCE降解率。
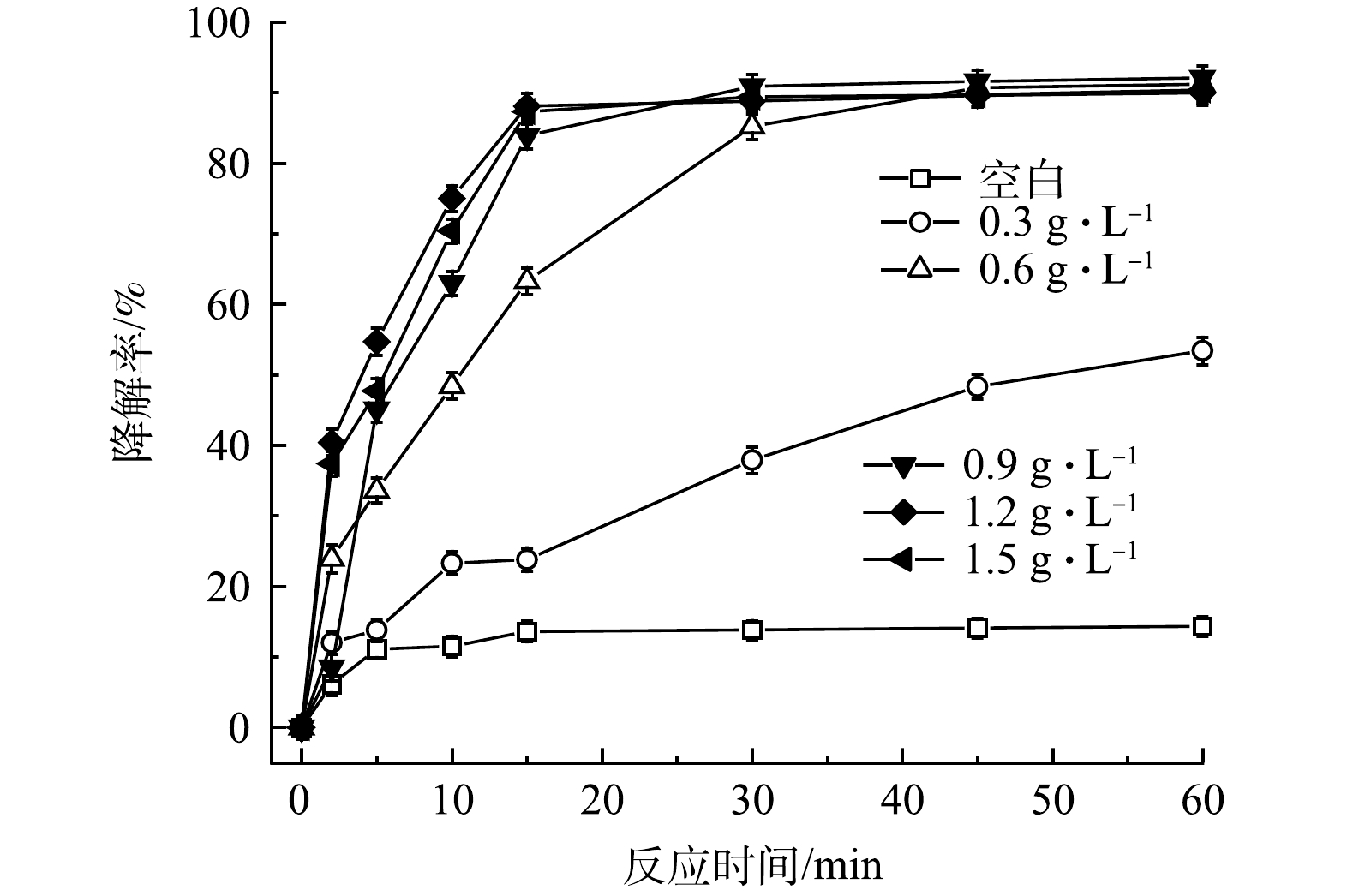
圖4 FeS劑量對TCE降解效果的影響
溶解性鐵濃度在反應過程中的變化情況如圖5所示。隨著反應的進行,體系中Fe(Ⅱ)和溶解性總鐵含量不斷上升,在60min內從初始點0分別增加至0.35mmol·L−1和0.90mmol·L−1,特別是在15min后Fe(Ⅱ)濃度增加較大。而Fe(Ⅲ)濃度的變化不同于兩者,Fe(Ⅲ)含量(溶解性總鐵含量減去Fe(Ⅱ)含量)在0、2、5、10、15、30、45和60min時刻分別為0、0.24、0.42、0.54、0.65、0.61、0.55和0.55mmol·L−1。可以看出,Fe(Ⅲ)含量在前15min大幅度增加,之后略微減少,最后保持穩定,由此可以間接判斷在反應后期部分Fe(Ⅲ)轉變為Fe(Ⅱ),使其顯著優于PMS/Fe(Ⅱ)體系。同時,反應結束后體系中Fe(Ⅱ)濃度為0.35mmol·L−1(19.6mgL−1),根據《地下水質量標準》(GB/T14848-2017),鐵離子含量超過IV類水質標準規定的2mgL−1。為避免造成二次污染,可采用曝氣充氧的方法將水中Fe(Ⅱ)氧化為高價態離子,形成氫氧化鐵膠體,再經過濾處理后達到降低地下水中鐵離子含量的目的。

圖5 PMS/FeS體系中Fe(II)、Fe(III)及溶解性總鐵濃度變化
2.3 TW-80濃度對TCE降解效果的影響
TW-80的臨界膠束濃度(CMC)為13mg·L−1,考慮到在污染場地實際修復中常使用較高濃度的表面活性劑,故控制PMS、FeS和TCE的初始濃度分別為0.8mmol·L−1、0.6g·L−1和0.15mmol·L−1,設置不同濃度的TW-80(0、0.013、1.3、2.6和5.2g·L−1)以探究其對TCE降解效果的影響。如圖6所示,當添加0.013g·L−1(1CMC)的TW-80時,TCE的降解率由99.3%(空白)下降至97.3%,TCE的降解率僅下降了2%,由此推斷0.013g·L−1以內的TW-80對TCE降解的影響可忽略不計。當TW-80濃度增加至1.3、2.6和5.2g·L−1時,TCE降解率分別下降至90.0%、74.1%和59.7%。由上述實驗結果可知,當表面活性劑TW-80濃度超過0.013g·L−1時,其會在水溶液中形成膠束包裹TCE分子,反應過程中產生的SO4-·和HO·需先攻擊膠束,之后再攻擊TCE分子,因此,會消耗一部分SO4-·和HO·,進而影響TCE的降解。
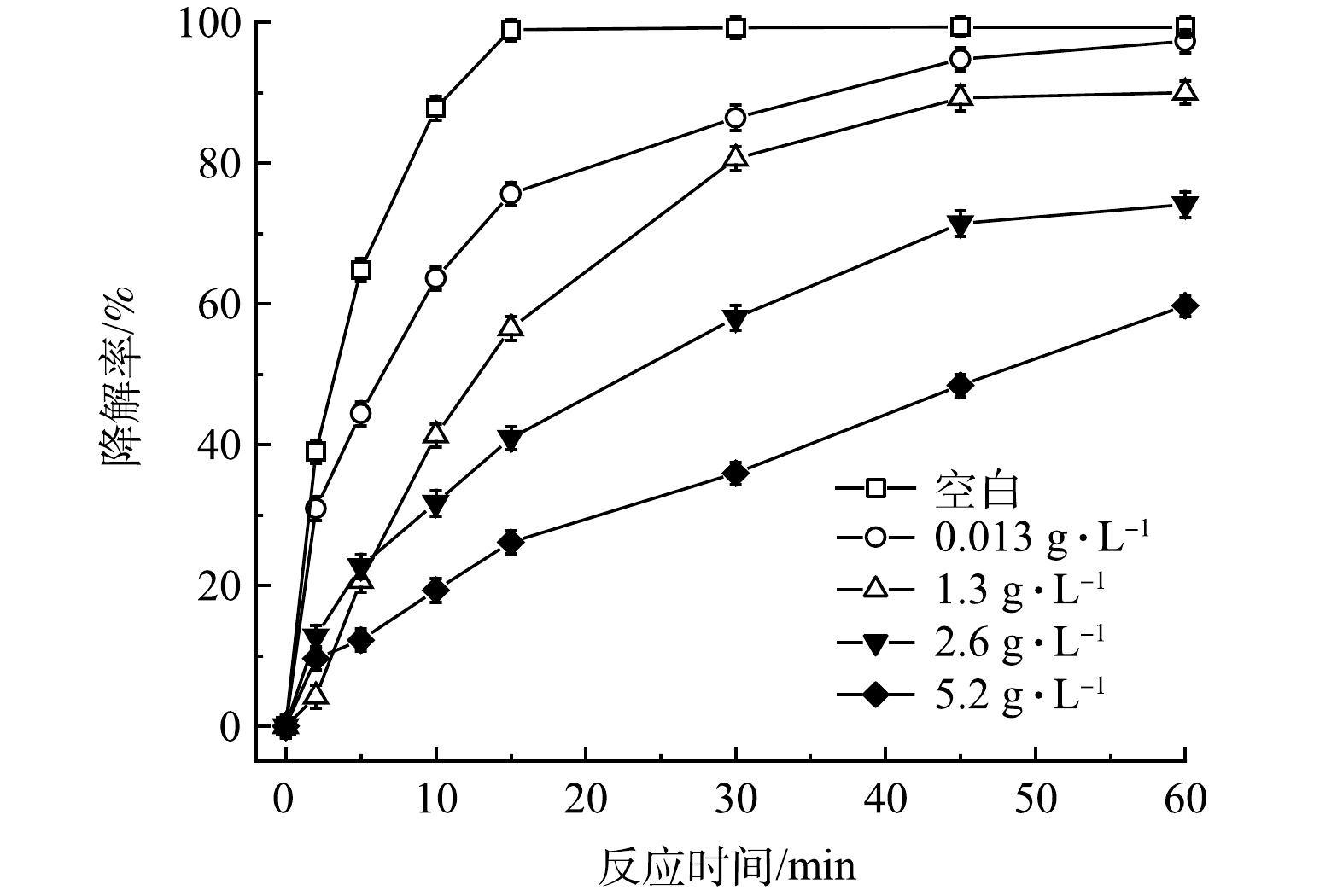
圖6 TW-80濃度對TCE降解效果的影響
為進一步證實TW-80會消耗體系中的自由基,包括HO·、SO4-·和O2-·,實驗選擇叔丁醇(TBA)作為HO·的淬滅劑,異丙醇(IPA)作為SO4-·和HO·的淬滅劑,三氯甲烷(trichloromethane)作為O2-·的淬滅劑,設置PMS、FeS、TW-80和TCE的初始濃度分別為0.8mmol·L−1、0.6g·L−1、1.3g·L−1和0.15mmol·L−1,在不添加淬滅劑以及分別添加100mmol·L−1TBA、100mmol·L−1IPA或50mmol·L−1CF時,探究TW-80在不同條件下的分解情況,結果如圖7所示。當不添加淬滅劑時,TW-80在60min內分解了51.5%;當分別添加TBA、IPA和CF后,TW-80分解率從51.5%分別降至44.6%、16.2%和37.7%。結果表明,HO·和SO4-·會直接攻擊TW-80使其分解,造成了自由基的消耗,而O2-·主要通過鏈式反應參與HO·和SO4-·自由基的生成,促進TW-80的分解,且相比于HO·和O2-·,SO4-·對TW-80的分解起主要作用。
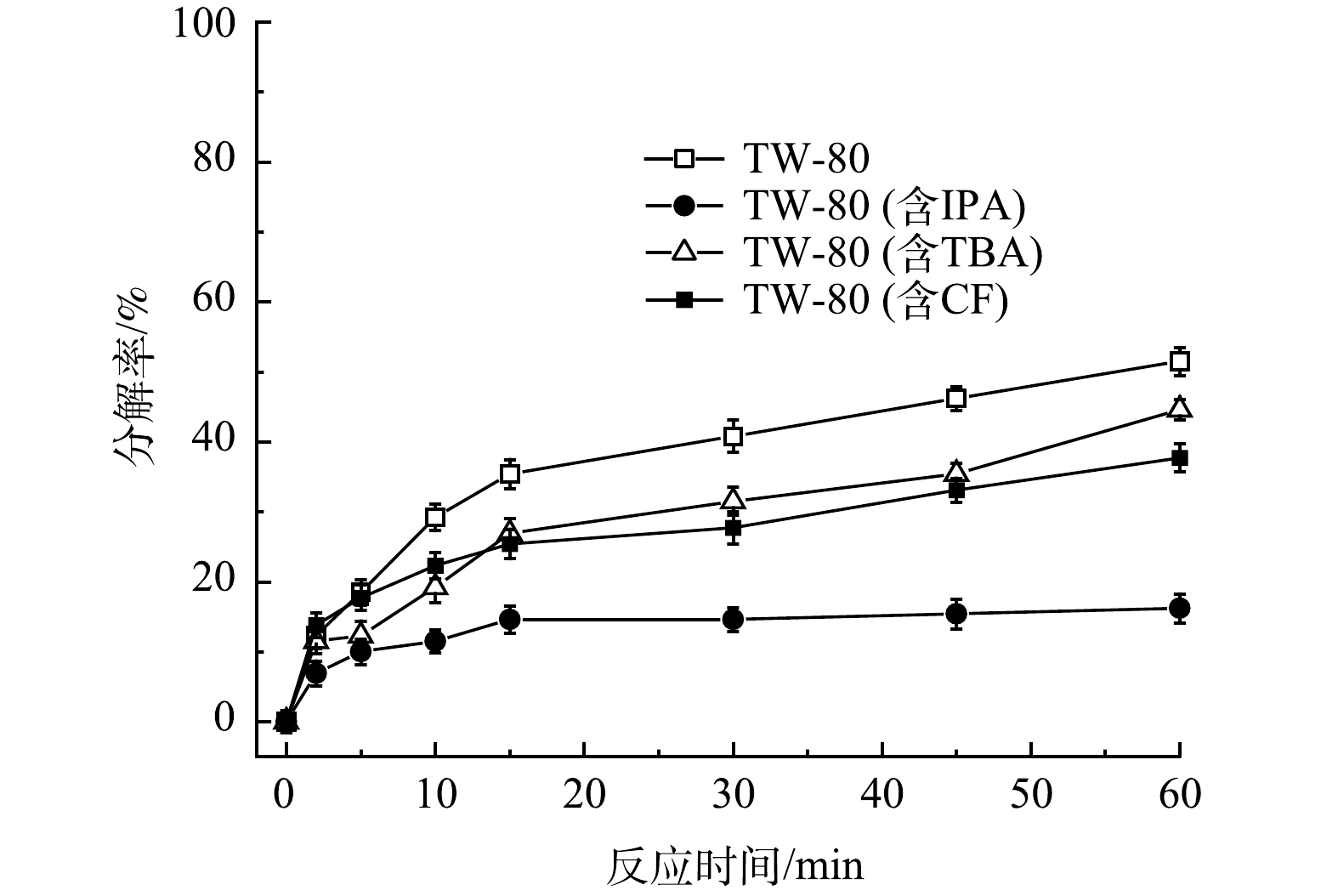
圖7 吐溫-80在不同自由基淬滅條件下的分解
2.4 水質條件對TCE降解效果的影響
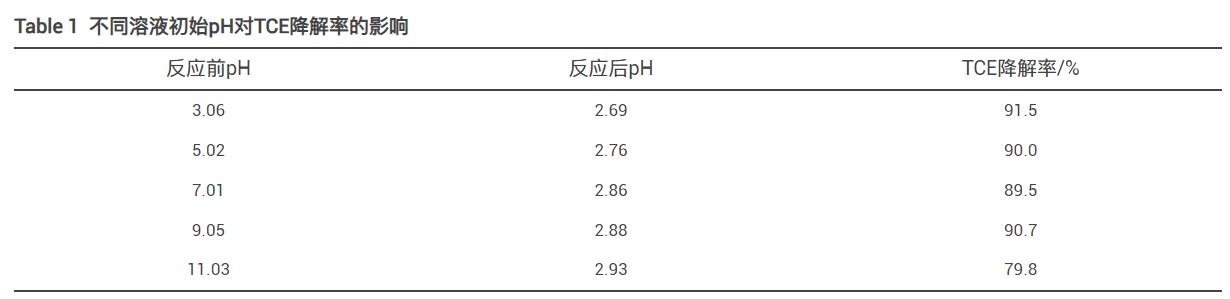
1)溶液初始pH。
溶液初始pH對PMS/FeS體系降解TCE有很大影響,因此在初始實驗條件下,探究pH其對TCE降解的影響。反應60min后溶液pH變化及TCE降解率如表1所示。當溶液初始pH為3、5、7和9時,60min內TCE降解率分別為91.5%、90.0%、89.5%和90.7%,無明顯變化;當pH為11時,TCE降解率有所下降,為79.8%。該結果表明,PMS/FeS體系在降解含TW-80的TCE時對溶液pH有較寬的適用范圍,反應結束后溶液pH均在3以下,這與PMS在水溶液中呈酸性有關。在酸性條件下,PMS能夠產生更多的自由基,攻擊TW-80和TCE分子,有利于TCE的降解。
2)無機陰離子。
在實際地下水中存在各種無機陰離子,其中Cl-和HCO3-對高級氧化影響較大。通過添加不同濃度的Cl-和HCO3-,探究其對TCE降解效果的影響。如圖8所示,與空白相比,當加入1mmol·L−1的Cl-后,TCE降解率從90.0%降至83.9%,隨著Cl-濃度增加,對TCE降解的抑制作用也越來越強,在加入5和10mmol·L−1Cl-條件下,TCE降解率從90.0%分別降至61.3%和58.7%。造成這種現象可能有兩方面的原因,首先,由式(11)可知,PMS會與Cl-發生反應,生成Cl2并消耗PMS,使反應過程中有效參與TCE降解的氧化劑減少;其次,HO·和SO4-·也會與Cl-反應生成Cl·和ClOH-(式(12)和式(13)),造成自由基的消耗。如圖9所示,HCO3-對TCE降解的抑制作用比Cl-更強。與空白相比,當加入1、5和10mmol·L−1HCO3-后,TCE降解率從90.0%分別降至65.3%、18.2%和18.1%。一方面,HCO3-的加入會使溶液pH升高,且HCO3-具有一定緩沖能力;另一方面,HCO3-也會淬滅HO·和SO4-·并生成氧化性較弱且選擇性較強的CO3-·自由基(式(14)和式(15)),造成體系中HO·和SO4-·的消耗。所以,當PMS/FeS體系內存在高濃度HCO3-時,TCE的降解會受到較強的抑制。
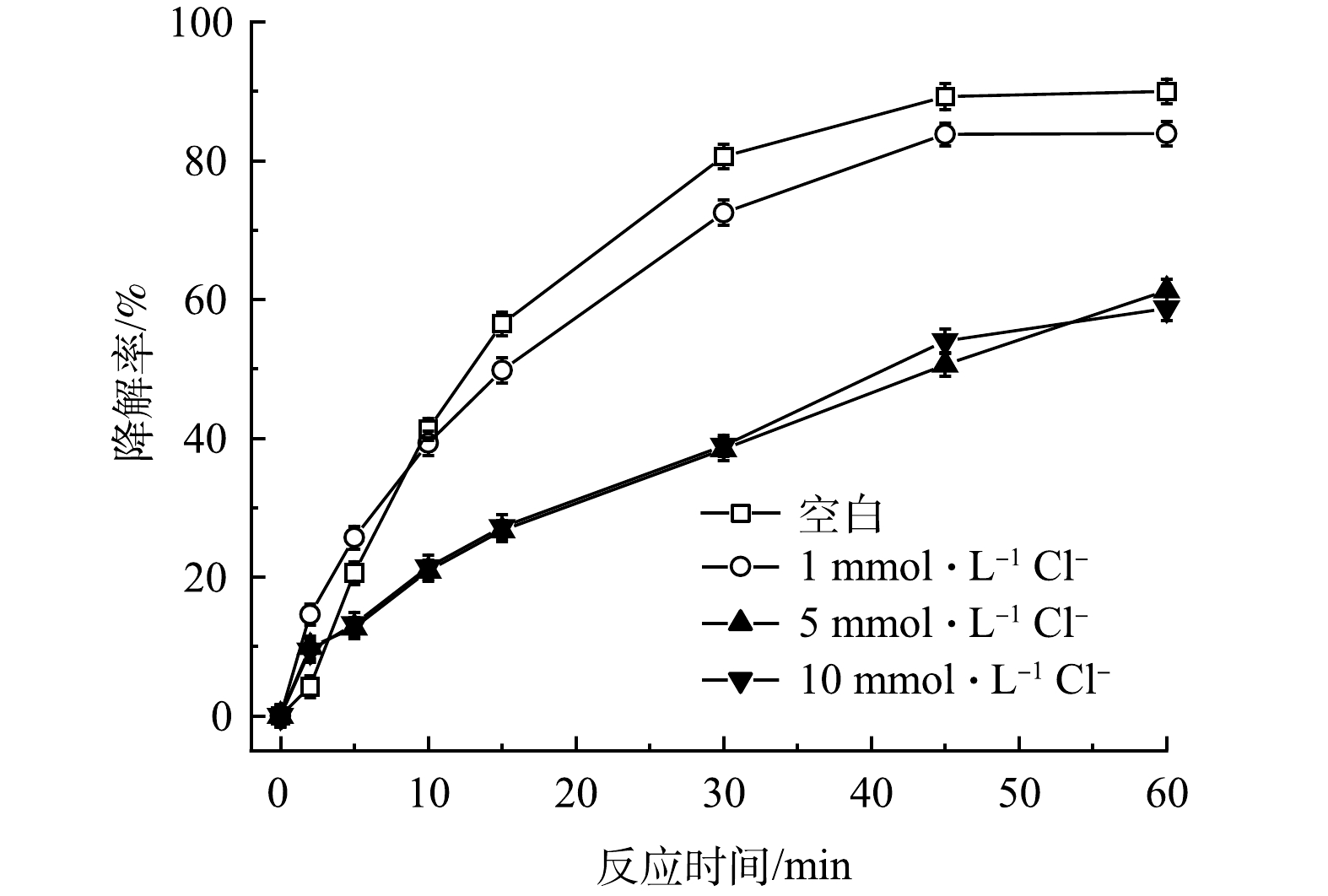
圖8 Cl-濃度對TCE降解效果的影響
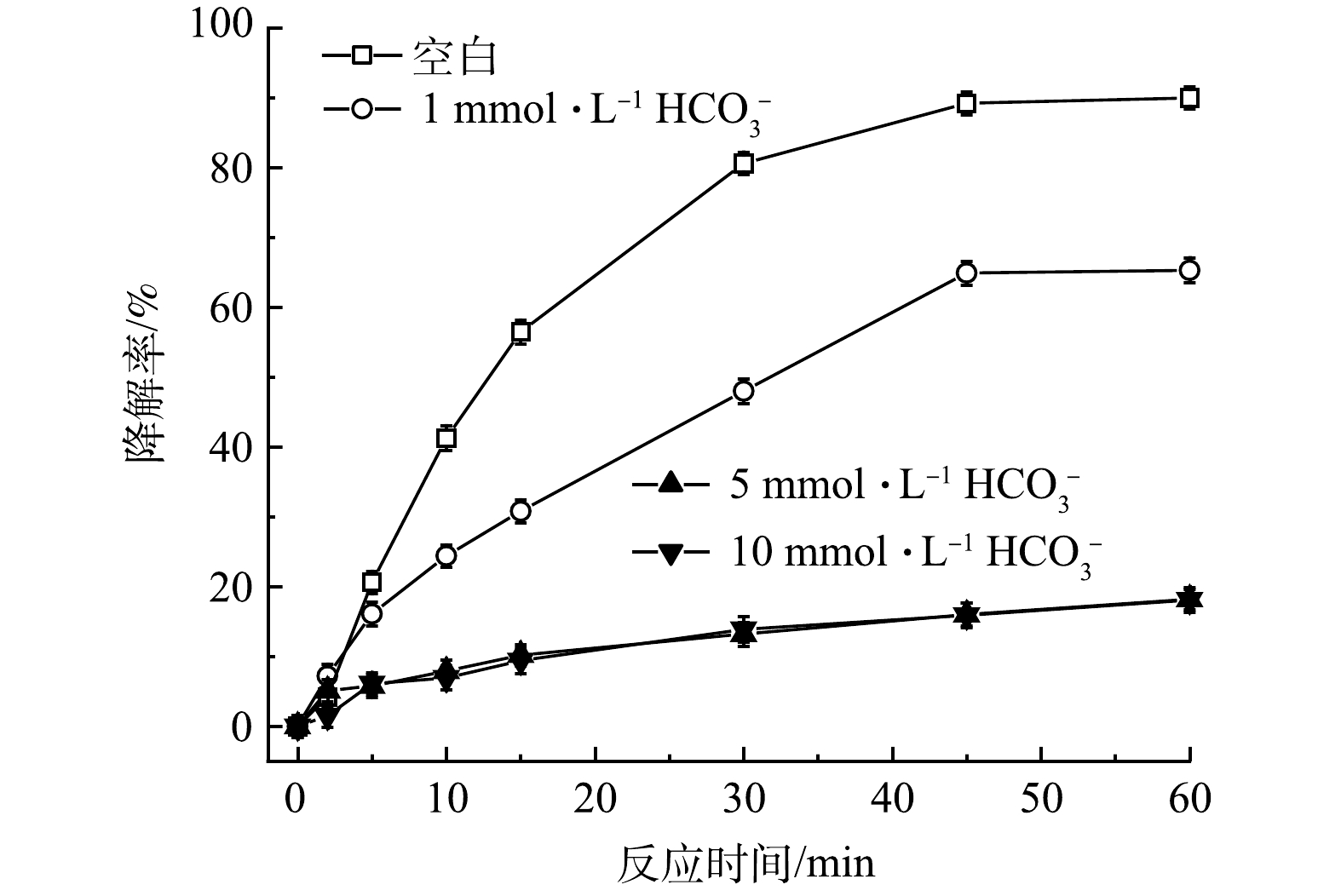
圖9 HCO3-濃度對TCE降解效果的影響
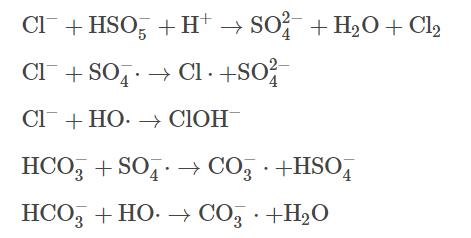
2.5 PMS/FeS體系中TCE的降解機制
1)自由基淬滅實驗。為了解PMS/FeS體系中產生的主導自由基種類,開展了自由基淬滅實驗。選擇叔丁醇(TBA)作為HO·的淬滅劑,異丙醇(IPA)作為SO4-·和HO·的淬滅劑,三氯甲烷(CF)作為O2-·的淬滅劑。結果如圖10所示。不加淬滅劑時,60min內TCE降解90.0%,當加入10和100mmol·L−1的TBA后,TCE降解率分別降至84.4%和69.3%,表明HO·是PMS/FeS體系中降解TCE的主導自由基之一;考慮到CF在水中溶解度較低,因此加入的CF最高濃度為50mmol·L−1。當加入10和50mmol·L−1的CF后,TCE降解率分別降至79.3%和67.4%,表明O2-·也是影響TCE降解的主導自由基之一;當加入10和100mmol·L−1的IPA后,TCE降解率分別降至31.1%和24.7%,表明SO4-·也是PMS/FeS體系中降解TCE的主導自由基之一,且SO4-·的貢獻程度比HO·和O2-·大。另外,這一結果也與SO4-·對TW-80分解的作用程度比HO·和O2-·大相一致。
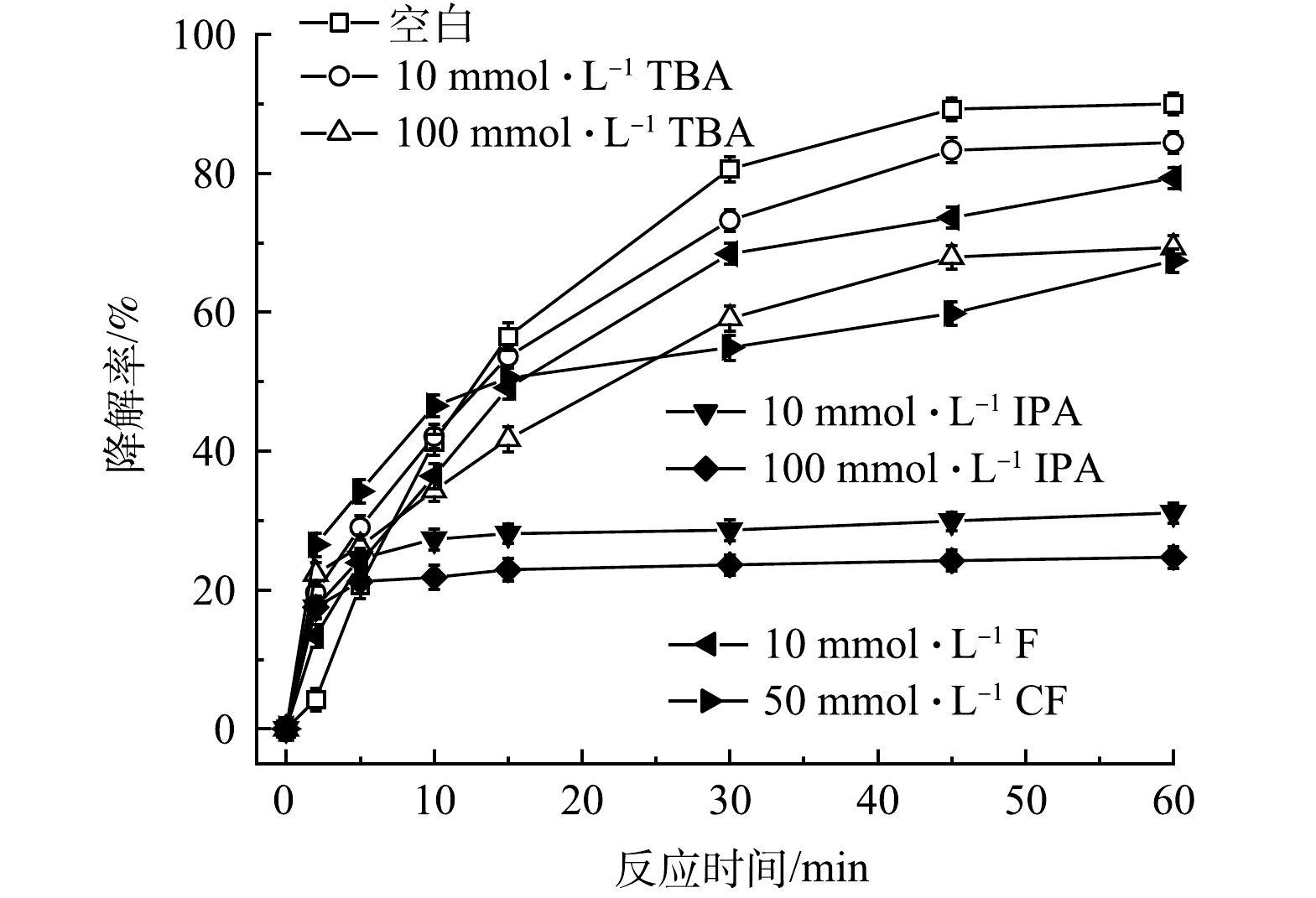
圖10 自由基淬滅劑對TCE降解效果的影響
2)電子順磁共振實驗。為了進一步驗證PMS/FeS體系中產生的自由基,選擇DMPO作為捕捉劑,利用電子順磁共振儀(EPR)探究體系中存在的自由基。反應15min后,如圖11所示,在EPR譜圖中檢測到DMPO-HO·和DMPO-SO4-·加合物的特征峰。這證明HO·和SO4-·是PMS/FeS體系中的主要自由基。
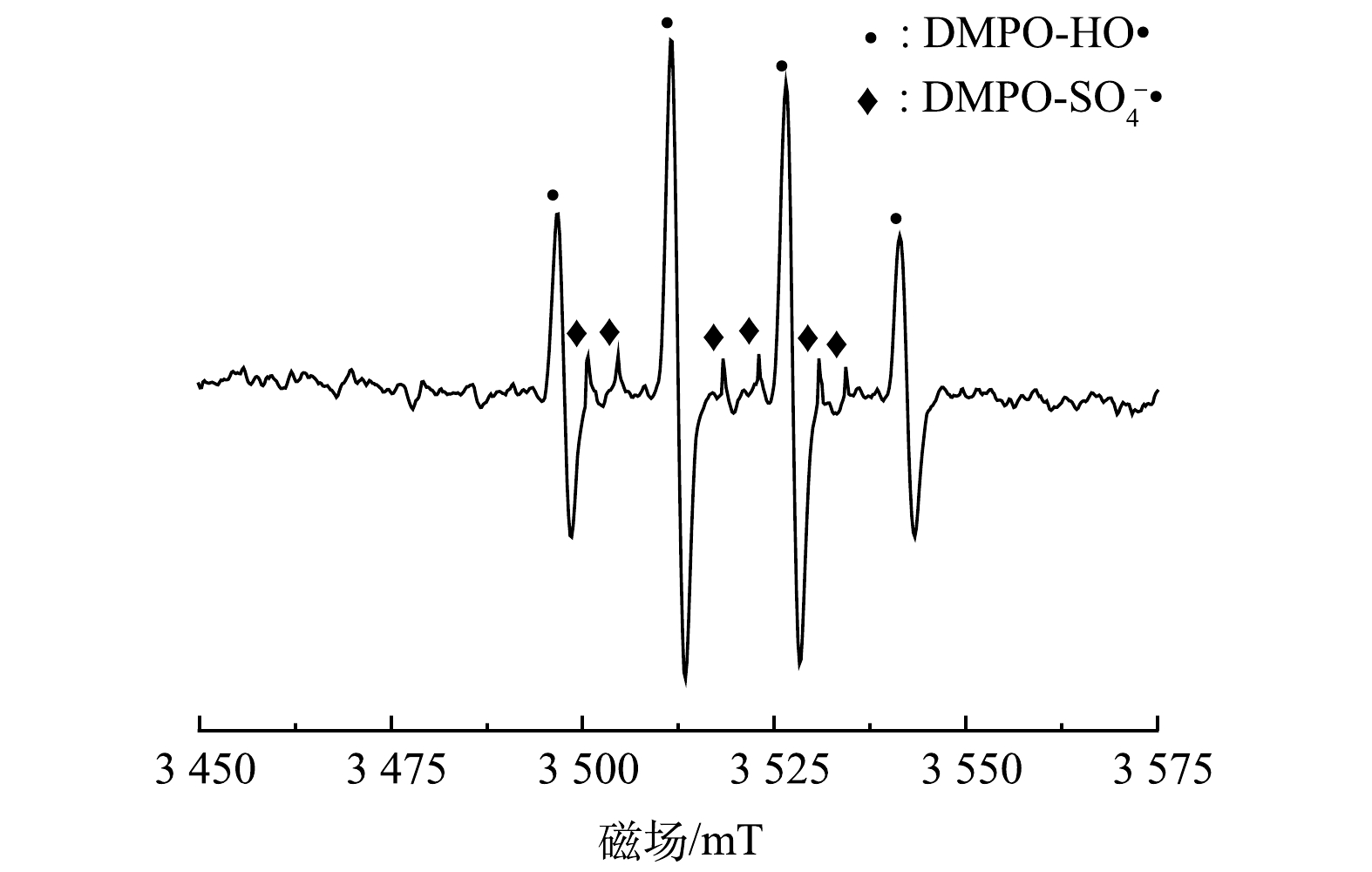
圖11 PMS/FeS體系中EPR譜圖
3)TCE脫氯及S形態的轉化。為探究含TW-80的TCE降解過程中脫氯情況,利用IC進一步測定了TCE降解過程中Cl-濃度變化,結果如圖12所示。隨著TCE的降解,Cl-釋放量逐漸升高,60min后達到66.6%,考慮到反應過程中5.7%的TCE揮發,因此實際Cl-的釋放率為72.3%。鑒于在此藥劑投加量下TCE的去除率為90%,扣除5.7%的TCE揮發量后理論Cl-釋放量為84.3%,可以計算出在TCE降解過程中超過85.8%的TCE被完全脫氯。
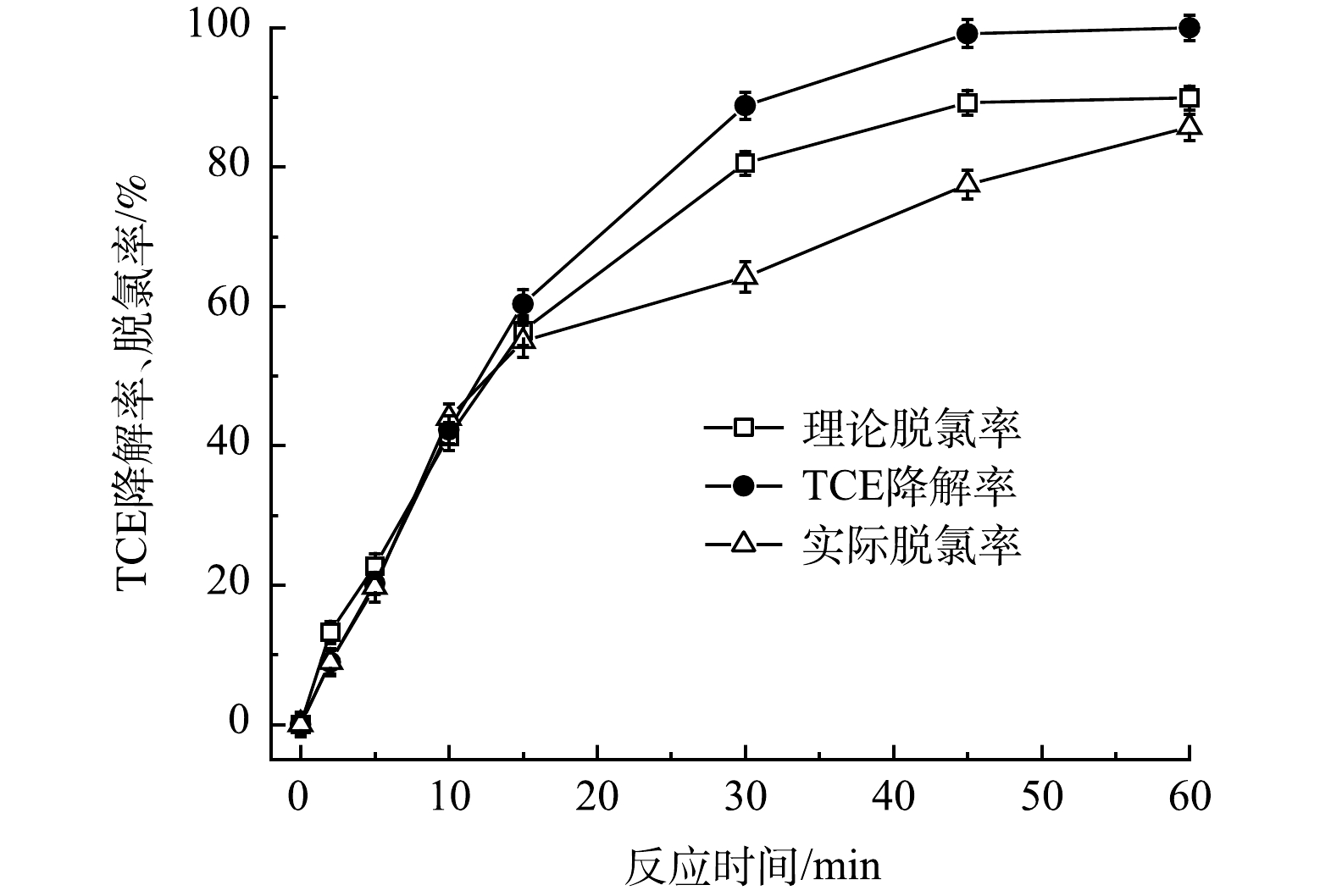
圖12 PMS/FeS體系中Cl-的釋放
在反應過程中FeS中的硫元素會轉化為SO42−,SO42−濃度(去除PMS自身分解產生的SO42−)隨時間的變化如圖13所示。在60min內,SO42−由0增加至127.3mg·L−1,FeS利用率達78.2%。表明在PMS/FeS體系中FeS充分發揮其還原作用,促進了體系中Fe(Ⅱ)/Fe(Ⅲ)循環和TCE的降解。
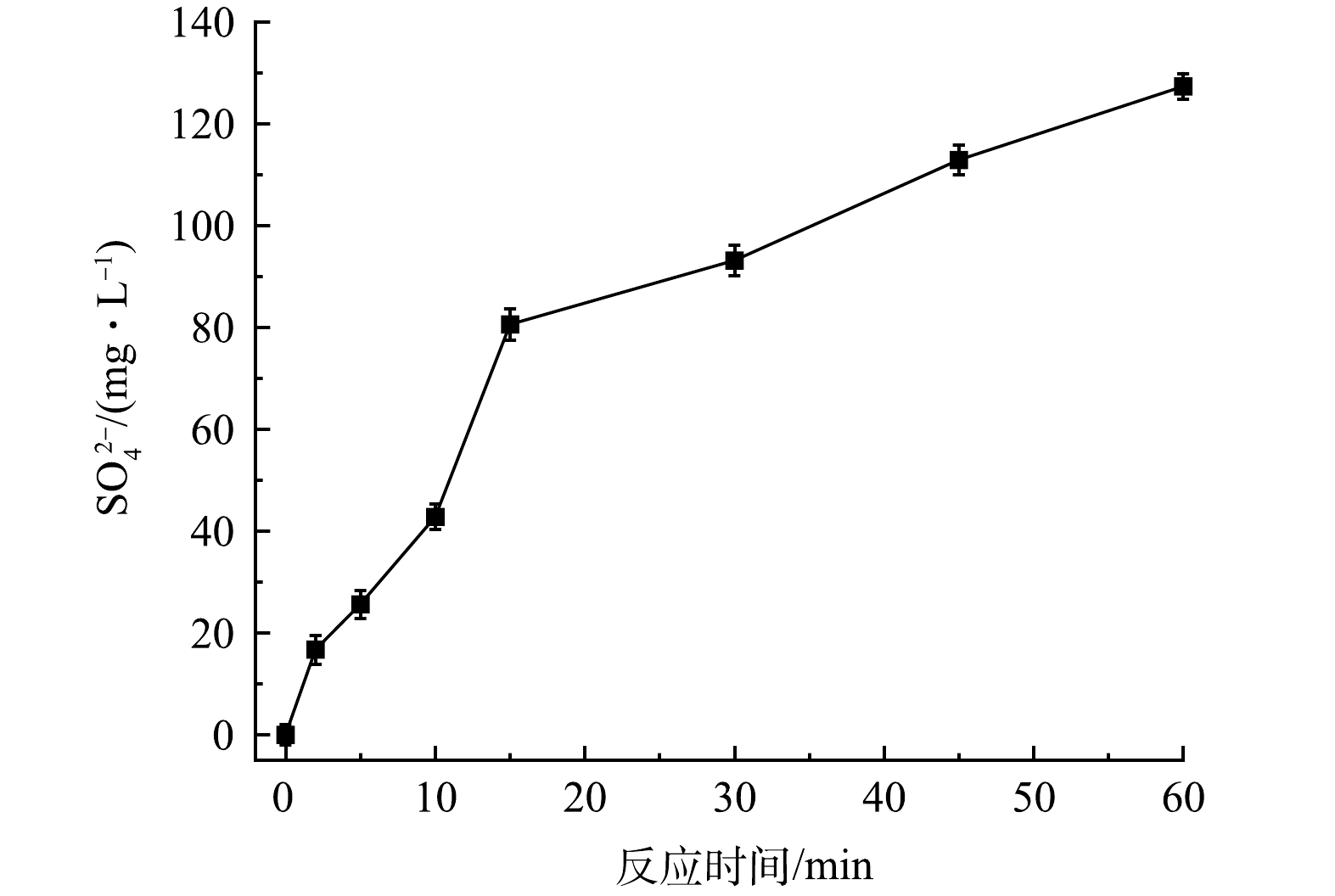
圖13 PMS/FeS體系中SO42-濃度變化
2.6 PMS/FeS體系對含TW-80的不同氯代烴降解效果的比較
在實際污染場地中除TCE外,還常有其他氯代烴污染物檢出,如四氯乙烯(PCE)、1,1,1-三氯乙烷(TCA)、四氯化碳(CT)、1,2-二氯乙烷(DCA)、三氯甲烷(CF)和二氯甲烷(DCM)等。利用PMS/FeS體系降解含TW-80的多種氯代烴實驗,PCE、TCA、CT、DCA、CF和DCM濃度均設置為0.15mmol·L−1。結果如圖14所示。在60min內超過63.9%的PCE和94.4%的CT被降解,但TCA、DCA、CF和DCM去除率分別僅為6.3%、3.5%、3.2%和1.7%,表明PCE能夠被PMS/FeS體系產生的自由基氧化。對于有機物CT,體系中產生的還原性O2-·自由基有助于CT的降解。此外,根據相關研究報道,表面活性劑在降解過程中會產生醇類等分解產物。HO·和SO4−·作為強氧化性自由基,可能會與醇類物質反應生成具有還原性的醇自由基。因此,CT作為高氯代有機物,能夠被高效降解的主要原因可能是由于其被相關醇自由基和體系中生成的O2-·還原所致。遺憾的是,TCA、DCA、CF和DCM降解率均未超過10%,表明PMS/FeS體系中產生的自由基無法促進上述烷烴的去除。

圖14 PMS/FeS體系中不同氯代烴的降解效果
2.7 PMS/FeS體系處理實際地下水中含TW-80的TCE效果
為驗證PMS/FeS體系在實際地下水中(含1.3g·L−1TW-80)降解TCE的效果,進一步開展了不同投加劑量及預先調節溶液pH實驗研究。實際地下水中TOC、Cl-、HCO3-、NO3-、CO32-、Ca2+、Ma2+質量濃度分別為16.44、134、91.2、0.408、172、59和55mg·L−1,pH為7.49。各種實驗條件下反應前后溶液pH變化如表2所示。當不調節溶液pH時,在0.8mmol·L−1PMS和0.6g·L−1FeS投加量下,如圖15所示,TCE降解率僅為6.8%;將PMS和FeS劑量增加至2倍和4倍時,TCE的降解率由6.8%分別增加到13.0%和26.7%。在實際地下水中的實驗結果與在超純水中的結果相差較大。其主要原因是實際地下水pH呈弱堿性,且存在高濃度的無機陰離子(Cl-和HCO3-/CO32-)。因此,增加藥劑量無法達到較好的降解效果,且增加修復藥劑成本。為了提高TCE降解率和節省修復成本,使用H2SO4將溶液初始pH預先調節為3,令人意外的是,在0.8mmol·L−1PMS和0.6gL−1FeS投加量下,TCE降解率達到63.8%,將PMS和FeS劑量同時增加至2倍和4倍,TCE降解率提高至70.2%和82.8%,相比未調節pH的實驗組,TCE降解率顯著增加。雖然反應后溶液pH在3以下,但可以采用生石灰等廉價堿性物質調節至中性。顯然,對于在實際工程中調節pH的應用,可以考慮通過注射井,在污染區域上游將表面活性劑注入,在表面活性劑的增溶和遷移作用下,通過下游提升井,利用水泵將表面活性劑和被增溶的有機污染物從污染區域下游抽出至地表進行處理,在地表上可預先調節溶液pH,經處理達標后可回灌至地下或通過市政管道納管排放。
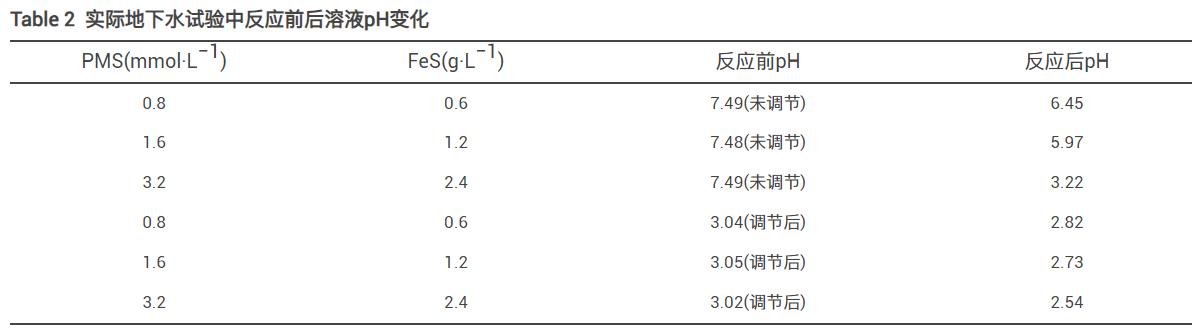
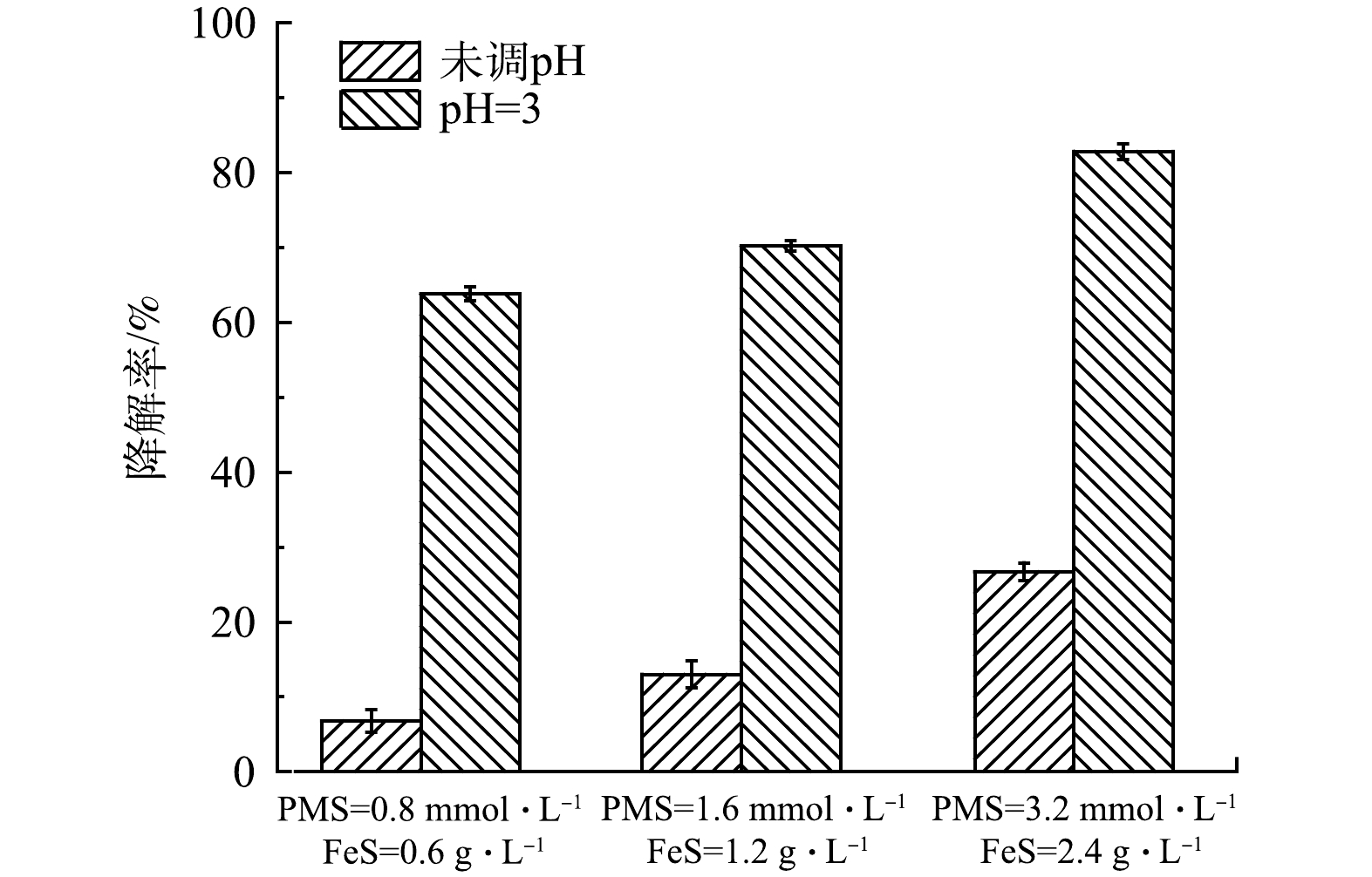
圖15 PMS/FeS體系對實際地下水中TCE的降解效果
3、結論
1)相比PMS/Fe(Ⅱ)體系,PMS/FeS體系對含TW-80的TCE降解效果更好,當藥劑投加量PMS為0.8mmol·L−1、FeS為0.6g·L−1時,60min內TCE降解率為90.0%,FeS的還原作用使反應過程中Fe(Ⅲ)及時還原成Fe(Ⅱ),促進Fe(Ⅱ)/Fe(Ⅲ)的循環。
2)TW-80會抑制TCE的降解,且TW-80濃度越高,抑制作用越強,PMS/FeS體系產生的自由基會攻擊TW-80,且SO4-·對TW-80分解起主要作用;在超純水實驗中PMS/FeS體系適應的pH范圍較寬,當pH在3~9時,TCE的降解效果均較好,當pH=11時,TCE降解受到抑制;HCO3-和Cl-均會影響TCE的降解,其中HCO3-對TCE降解的抑制作用更強。
3)SO4-·、HO·和O2-·是PMS/FeS體系降解TCE的主導自由基,其中SO4-·對降解的貢獻最大。
4)PMS/FeS體系對PCE和CT同樣具有較好的降解效果,但對其他氯代烷烴的降解效果不佳。
5)與超純水相比,PMS/FeS處理實際地下水中的TCE效果不佳;預先調節溶液pH=3后,TCE降解率顯著提高,表明PMS/FeS體系在修復實際地下水工程中具有較好的應用潛力。(來源:中石化(北京)化工研究院有限公司,華東理工大學資源與環境工程學院,國家環境保護化工過程環境風險評價與控制重點實驗室)



