1 引言
典型的設前置反硝化段的生物脫氮除磷工藝有厭氧/缺氧/好氧工藝(A2/O工藝)、University of Cape Town工藝(UTC工藝)及生物化學脫氮除磷工藝(BCFS工藝).反硝化段前置的優勢是厭氧合成的內聚物聚β羥基脂肪酸(PHA)等可直接進入缺氧段驅動反硝化而取得較好的脫氮效果,但前置反硝化段有其固有的缺陷.根據生物脫氮理論,硝化段(好氧段)內氨氧化菌(AOBs)將氨鹽氧化為亞硝酸鹽后,亞硝酸鹽氧化菌(NOBs)將亞硝酸鹽氧化為硝酸鹽;反硝化段(缺氧段)內反硝化菌將硝酸鹽還原為亞硝酸鹽,并進一步還原為氮氣(N2)(Zhou et al., 2011).由于好氧段在缺氧段后,為實現反硝化,因而必須將混合液從好氧段回流至缺氧段.混合液回流會稀釋進水有機質濃度;氧化態氮(NO-x)的去除也受制于混合液的回流速率,且完全脫氮不可能實現;混合液回流還會增加能量消耗和工藝復雜度.
缺氧段置于好氧段之后的后置缺氧反硝化方式,因省去了混合液回流而簡化了工藝流程,且能實現較好的脫氮除磷效果而得到了廣泛的研究.與前置反硝化相比,外碳源已在厭氧段或好氧段消耗,后置缺氧段反硝化菌以內碳源(糖原或PHA)為電子供體,以NO-x為電子受體驅動反硝化.Coats 等(2011)和Winkler等(2011)研究了后置缺氧序批式反應器(SBR)工藝,Bracklow等(2010)和Vocks等(2005)研究了連續流后置缺氧膜生物反應器(MBR)工藝,均取得了良好的脫氮除磷效果.這些研究表明,后置缺氧段雖未外加碳源,但微生物可利用胞內糖原或PHA驅動反硝化脫氮.此外,Xu等(2011)在后置缺氧反硝化的基礎上將部分厭氧段混合液分配進缺氧段實現反硝化除磷,并在好氧段實現了同步硝化-反硝化.這種改進雖然實現了反硝化除磷,但又增加了工藝復雜程度.后置反硝化的厭氧/好氧/缺氧SBR工藝解決了混合液回流的問題,但該工藝是否有進一步改進的空間?
根據傳統生物強化除磷(EBPR)理論,EBPR通過厭氧/好氧或厭氧/缺氧交替運行實現.這種條件為聚磷菌(PAOs)代謝生長提供選擇性優勢,使之能厭氧吸收揮發性脂肪酸(VFAs)合成為PHA,并好氧吸收磷酸鹽(Coats et al., 2011).PAOs厭氧吸收VFAs的能量來源于聚磷降解和糖原分解,而糖原分解為PHA合成提供還原力(Smolders et al., 1994).在好氧或缺氧條件下,PAOs通過三羧酸循環(TCA)為自身生長、糖原儲存、磷酸鹽攝取和聚磷合成提供能量(Smolders et al., 1995).EBPR系統中也存在聚糖菌(GAOs),這種微生物除不能厭氧釋磷和好氧攝磷外,其他代謝方式與PAOs相似,故能與PAOs形成競爭關系,影響除磷效果.因此,為達到聚磷菌釋磷的目的,活性污泥需經厭氧攪拌以充分接觸污水中VFAs.聚磷菌能通過聚磷分解供能吸收VFAs,但筆者研究厭氧/好氧/缺氧SBR工藝時發現,進水后未厭氧攪拌而靜置1 h后直接曝氣,靜置期系統中仍可監測到磷酸鹽的大量釋放,且曝氣開始后磷酸鹽仍能被快速過量吸收.同時,后置缺氧段實現了反硝化脫氮,從而達到了脫氮除磷的目的.在未攪拌而直接靜置階段,雖未與污水充分接觸系統,活性污泥為什么能像傳統厭氧段那樣大量釋磷?該階段聚磷菌釋磷與傳統厭氧釋磷有什么異同之處?由于并未攪拌,靜置段聚磷菌代謝方式會不會與傳統厭氧段聚磷菌代謝方式有所不同?靜置段的設置對好氧攝磷及缺氧反硝化脫氮影響有哪些?反硝化脫氮是不是也通過內聚物驅動,是通過糖原還是PHA或兩者均有?這些問題都值得深入研究.同時,若靜置/好氧/缺氧SBR可達到與厭氧/好氧/缺氧SBR相當甚至更好的脫氮除磷效果,以靜置段代替厭氧段并省卻攪拌,將簡化工藝并節省能量,這也是在后置缺氧工藝上的進一步優化探索.眾所周知,氮磷大量排放會引起水體富營養化,導致水質惡化,而傳統生物脫氮除磷工藝運行成本高.因此,這種探索對于簡化工藝、節約成本、防治水體富營養化具有重要的理論和實際意義,值得更深入地研究分析.
因此,本文以乙酸鈉為單一碳源,考察靜置/好氧/缺氧SBR長期運行中脫氮除磷性能,并設置厭氧/好氧/缺氧SBR以進行對比.由于本研究以靜置段替代傳統厭氧段,因而首先必須探究靜置段聚磷菌代謝機理,以論述靜置段與傳統厭氧段的異同點及靜置段在靜置/好氧/缺氧SBR的地位作用.其次考察兩系統釋磷、好氧攝磷、同步硝化-反硝化及缺氧反硝化異同點.然后分析靜置段替代厭氧段對系統攝磷、硝化及反硝化有哪些影響,以深入研究靜置/好氧/缺氧SBR的脫氮除磷性能.最后,根據脫氮除磷效果,對靜置/好氧/缺氧SBR可否替代厭氧/好氧/缺氧SBR作初步判斷,以期為后置缺氧工藝的研發與應用提供新思路.
2 材料與方法
2.1 試驗裝置與運行方法
試驗在2個相同的SBR中進行,反應器有效體積為1.8 L.接種的活性污泥取自長沙市第一污水處理廠,起始活性污泥濃度約為4000 mg · L-1.R1運行方式如下:進水→靜置(1 h)→曝氣(2.5 h)→缺氧攪拌(3 h)→沉淀出水(0.5 h)→閑置(1 h);R2運行方式如下:進水→攪拌(1 h)→曝氣(2.5 h)→缺氧攪拌(3 h)→沉淀出水(0.5 h)→閑置(1 h).好氧采用鼓風曝氣,曝氣量控制為1.5 L · min-1.水力停留時間(HRT)為12 h.控制污泥停留時間為20 d,整個過程中不控制pH.
2.2 污水水質
兩反應器進水采用合成廢水,進水成分及濃度一致.乙酸鈉(10.88 mmol · L-1,以C計,理論COD值為350 mg · L-1)為單一碳源,氨氮采用氯化銨(40 mg · L-1,以NH+4-N計),溶解性正磷酸鹽(SOP)采用磷酸二氫鉀(12 mg · L-1,以PO3-4-P計).此外,CaCl2及MgSO4濃度皆為5 mg · L-1,微量元素溶液為0.5 mL,其組分及濃度見文獻(Wang et al., 2008).
2.3 分析方法
PHA測定采用氣相色譜法(Wang et al., 2008);NO-2-N測定采用N-(1-萘基)-乙二胺分光光度法,SOP測定采用鉬銻抗分光光度法,NO-3-N測定采用紫外分光光度法,混合液揮發性懸浮固體濃度(MLVSS)測定采用重量法,NH+4-N測定采用納氏試劑分光光度法,具體方法參照文獻(國家環保總局《水和廢水監測分析方法》編委會,2002);污泥中總磷(TP)采用NaOH熔融鉬銻抗分光光度法測定(Wang et al., 2009),糖原(Glycogen)采用苯酚-硫酸法測定(Wang et al., 2009),廢水總有機碳濃度(TOC)采用TOC測定儀(ShimadzuTOC-500,日本)測定.
3 結果與分析
3.1 靜置段微生物代謝分析
由于靜置段與傳統厭氧段有所不同,而這種差異是否影響微生物代謝,進而影響生物強化除磷效果值得探討.本文將從釋磷、VFA攝取、糖原分解及PHA合成等方面進行分析.運行穩定階段,R1和R2典型周期內SOP、TOC、糖原和PHA(聚β羥基丁酸(PHB)+聚β羥基戊酸(PHV)+聚二甲基三羥基戊酸(PH2MV))一個周期內的變化情況如圖 1所示.

圖 1 R1(a)和R2(b)典型周期內SOP、糖原和PHA的變化
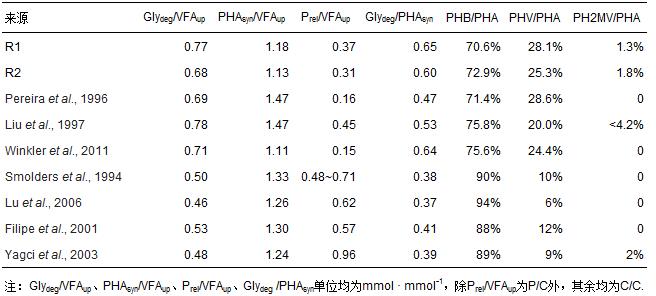
R2厭氧段迅速釋磷,釋磷量為74.34 mg · L-1,釋磷速率為24.11 mg · g-1 · h-1(以每g VSS釋放的P(mg)計).R1靜置段釋磷量相對較少,但仍有38.67 mg · L-1,釋磷速率為12.86 mg · g-1 · h-1. Montil 等(2005)和Mamais等(1992)認為傳統EBPR工藝厭氧段磷酸鹽釋放速率分別為5~30 mg · g-1 · h-1和7~20 mg · g-1 · h-1. 雖然R1釋磷量僅為R2的1/2,但與傳統厭氧段釋磷速率相比,R1靜置段釋磷速率在其變化范圍內且偏高.這表明進水后雖未攪拌活性污泥,但R1中聚磷菌仍可較快分解聚磷以迅速吸收水中VFA,故其靜置釋磷速率仍較高.可見,R1系統內雖無傳統厭氧段,聚磷菌仍能優勢生長.與R2厭氧段一致,R1靜置段也會發生糖原分解及PHA合成.R1靜置段和R2厭氧段釋磷量(Prel)、VFA攝取量(VFAup)、PHA合成量(PHAsyn)及糖原降解量(Glydeg)之間的轉化比例和PHA各組分百分比與文獻報道的傳統厭氧段的數據比較結果見表 1.
R1靜置段PHA合成量、糖原分解量及釋磷量在傳統厭氧段的變化范圍內,表明PAOs在靜置段內的代謝方式與傳統厭氧段內的代謝相似.由表 1可知,R1和R2的Glydeg/PHAsyn分別為0.65、0.60.Arun 等(1988)和Carvalho等(2007)認為該比例在0.28~0.36之間或更高時預示EBPR運行成功.當Prel/VFAup較小(0.15~0.45),而Glydeg/VFAup較高(0.67~0.78)時,PHV占PHA比重(PHV/PHA)明顯偏高(20.0%~28.6%);相反,當Prel/VFAup較高(0.48~0.96),而Glydeg/VFAup較低(0.46~0.53)時,PHV占PHA比重(PHV/PHA)明顯偏低(6%~12%).乙酸鈉作為碳源被PAOs吸收后,直接轉化為乙酰-CoA,后者將聚合成PHB.但PAOs能通過還原性三羧酸循環(TCA)+琥珀酸-丙酸途徑生成丙酰-CoA,進而與乙酰-CoA合成PHV(Kortstee et al., 2000).本研究中R1和R2 的Prel/VFAup偏低,而Glydeg/VFAup和PHV占比偏高.某些聚磷菌可能更多地依賴糖原降解,而還原性TCA可平衡源于糖酵解產生的還原力(Oehmen et al., 2010).據此推斷,聚磷菌更多地依賴糖原降解提供能量,產生較多還原力,因而為了平衡還原力,PAOs通過該途徑合成較多的丙酰-CoA,進而合成較多的PHV.以上分析表明,靜置段能起厭氧段作用而省卻了攪拌,聚磷菌能優勢生長并快速釋磷,為好氧迅速攝磷奠定基礎.當然,本研究所采用的反應器較小,在一定程度上利于物質傳遞.而對于較大反應器是否有同樣效果,以及其相應的改良措施則需進一步研究.
表1 傳統厭氧段與靜置段的化學計量數及PHA組分百分比的比較(以乙酸鈉為碳源)
3.2 R1和R2除磷性能比較
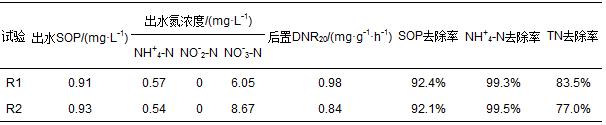
PAOs在兩系統好氧段均能迅速吸收廢水中的磷酸鹽.R1、R2中SOP分別從好氧段初的46.67、82.34 mg · L-1下降到好氧段末的2.32、0.93 mg · L-1,其磷酸鹽的平均吸收速率分別為5.90、9.53 mg · g-1 · h-1,R2高于R1.R2厭氧段聚磷菌釋磷更充分,因而攝磷速度更快,好氧段末SOP即在1 mg · L-1以下;而R1靜置段釋磷較R2少,攝磷速度亦相對較慢.從好氧代謝看,R1與R2相同,隨著磷的攝取R1好氧段發生PHA降解與糖原補充,但R2的Glysyn/PHAoxi較R1小(表 2),其原因可能是在R2厭氧段釋磷更多的情況下,R2中聚磷菌氧化PHA所獲能量較多地用于SOP攝取及聚磷合成,而用于糖原補充則相對較少,故Glysyn/PHAoxi較小.雖然R1好氧段末SOP較高,為2.32 mg · L-1,但隨著反硝化進行,SOP逐漸吸收,從而使SOP在缺氧結束時降至0.91 mg · L-1.因此,推斷R1中存在反硝化聚磷菌(DPAOs),能以NO為電子受體攝取SOP(Xu et al., 2011),反硝化攝磷速率為0.18 mg · g-1 · h-1.脫氮的同時使SOP濃度進一步降低,達到與R2相當的除磷效果.R1和R2長期運行過程中的除磷效果見圖 2.由圖 2可知,R1和R2長期運行過程中,除磷效果穩定良好,平均出水濃度分別為0.91和0.93 mg · L-1,平均去除率分別為92.4%和92.1%.與設厭氧段的R2相比,設靜置段的R1具有相當的除磷效果.這表明與厭氧/好氧/缺氧SBR相比,靜置/好氧/缺氧SBR能在長期運行過程中取得與之相當的良好除磷效果.

圖 2 R1和R2長期運行的除磷效果
表2 好氧段和后置缺氧段微生物代謝
3.3 R1和R2脫氮性能比較
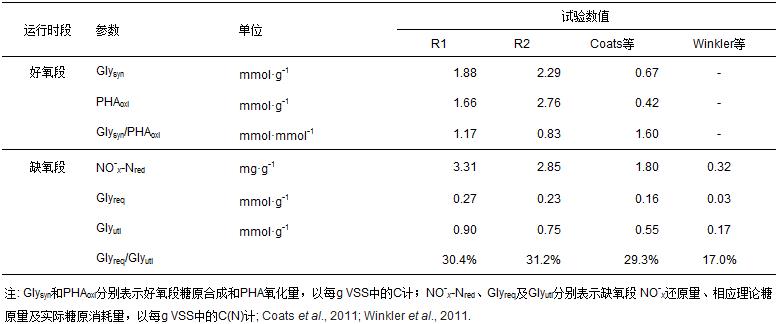
圖 3為R1和R2典型周期內NH+4-N、NO-2-N和NO-3-N的變化情況.由圖 3可知,好氧段內兩系統中的氨氮幾乎被完全氧化,至好氧段末R1和R2中氨氮濃度分別為0.27、0.19 mg · L-1,去除率分別為99.3%和99.5%.氨氮被氧化成硝氮或亞硝氮,但由圖 3可知,好氧段氨氮減少量與NO-x生成量差距較大,因此,可考慮好氧段是否發生同步硝化-反硝化.好氧段氨氮主要有3個去向:氧化成NO-x,同步硝化-反硝化為N2及細胞同化為生物氮.生物氮可以細胞分子式 C5H7NO2計算(N占比12%)(Bruce et al., 2001).因反應器中總生物量處于平衡狀態,則每個周期排放的污泥量應相當于該周期新增的生物量.每周期混合液排放量為30 mL,再由MLVSS和生物氮占比可計算每周期同化生物氮量.同步反硝化脫氮量(SDN)由被氧化的氨氮扣除生成的NO-x和同化的生物氮而得.經計算,R1和R2同步反硝化脫氮量分別為4.84、2.62 mg · L-1,分別占進水總氮的18.0%、9.8%(表 3).好氧段發生同步反硝化的原因可能是活性污泥絮凝體從表面到內核,氧的分布并不均勻.外層為好氧區,進行硝化反應;內層為缺氧區,進行反硝化反應.Satoh等(2003)發現硝化和反硝化能在絮凝體的不同區域同時進行.此外,也有可能存在好氧反硝化菌(Kim et al., 2005).雖然進水氨氮濃度相同,但R1同步反硝化脫氮量比R2多,可能是由于R1中氨氧化菌(AOBs)相對亞硝酸鹽氧化菌(NOBs)更多,從而亞硝酸積累量更多.由圖 3可知,好氧段內R1中亞硝酸鹽積累量可達6.31 mg · L-1,而R2中亞硝酸鹽積累量最多僅為2.40 mg · L-1,因而更多的亞硝酸鹽可能直接通過短程反硝化還原為氮氣,而不必進一步氧化為硝酸鹽再逐步還原為氮氣;而R2積累的亞硝酸較少,可能因其進一步氧化為硝氮,故反硝化時需先還原為亞硝氮再還原為氮氣.因此,R1同步硝化-反硝化更快.
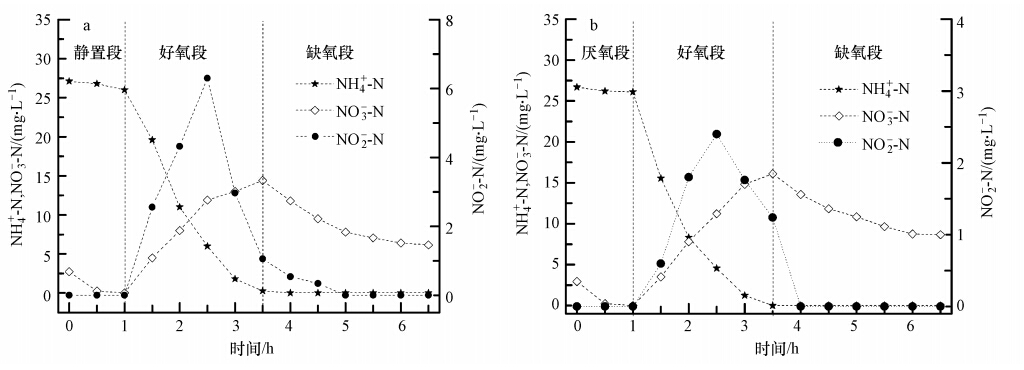
圖 3 R1(a)和R2(b)典型周期內NH+4-N、NO-2-N和NO-3-N的變化
R2外碳源在厭氧段已完全消耗,而R1外碳源在靜置段結束時雖有剩余,但曝氣后則立即吸收,即R1和R2缺氧段已無外碳源.由圖 1和圖 3可知,R1和R2缺氧段內NO-x逐漸下降,且此時PHA保持平穩并未下降,而糖原則逐漸下降,因此,可推斷R1和R2在缺氧段發生了以NO-x為電子受體,以胞內糖原為電子供體的后置反硝化反應,這與Coats 等(2011)和Winkler等(2011)的報道一致.微生物內源性衰解驅動反硝化速率為0.2~0.6 mg · g-1 · h-1(Kujawa et al., 1999),本文中R1和R2后置反硝化速率分別為0.98和0.84 mg · g-1 · h-1.Coats等(2011)和Winkler等(2011)測得后置反硝化速率分別為0.67~0.88 mg · g-1 · h-1和0.31~0.95 mg · g-1 · h-1(20 ℃校正,校正公式見文獻(Vocks et al., 2005)).可見,R1和R2后置反硝化速率高于微生物內源性衰解反硝化速率,而與文獻報道的后置反硝化速率相當.每還原一定量的硝氮需相應一定量的糖原,2.86 mg(COD)/mg(NO-3-N)表示每還原1 mg NO-3理論上需2.86 mg COD(Winkler et al., 2011).據此計算,每還原1 mg NO-2-N則需1.14 mg COD.為更好地探討糖原驅動后置反硝化脫氮,統計了硝氮與糖原之間的定量關系數據,具體見表 2.從表 2可知,R1和R2缺氧還原硝氮理論所需糖原分別占缺氧實際消耗糖原的30.4%和31.2%,這與Coats 等(2011)的研究結果相當,而較Winkler等(2011)的研究結果高.缺氧段不到1/2的糖原用于硝氮還原,剩余糖原可能通過糖酵解為微生物供能以維持生長.R1缺氧消耗糖原較R2多,其硝氮還原量亦較多(表 2).R1反硝化速率高于R2,可能就是由于R1缺氧段分解的糖原量(0.90 mmol · g-1)較R2(0.75 mmol · g-1)分解的多(表 2).至于為何R1缺氧糖原分解量較R2多,其原因可能是R2 好氧段氧化PHA所獲能量更多地用于SOP攝取及儲存,用于糖原補充則相對較少,從而導致缺氧段糖原分解較少.由表 2還可知,R1中Glysyn/PHAoxi較R2小.R1和R2缺氧段反硝化速率(DNR)如表 4所示.具體參見污水寶商城資料或http://www.bnynw.com更多相關技術文檔。
表3 R1和R2好氧段同步硝化-反硝化
表4 R1和R2缺氧段反硝化速率
綜合對比R1和R2好氧段和缺氧段脫氮性能發現,設置靜置段的R1比設置厭氧段的R2有更高的同步硝化-反硝化脫氮量和反硝化速率,故在氨氮氧化量幾乎相同情況下,R1硝氮出水濃度較R2低(表 4).因而具有更好的脫氮效果.R1和R2長期運行過程中脫氮效果見圖 4.由圖 4可知,長期運行過程中R1和R2脫氮效果穩定,平均出水TN分別為6.62和9.21 mg · L-1,平均脫氮率分別為83.5%和77.0%.可見,R1脫氮效果好于R2.
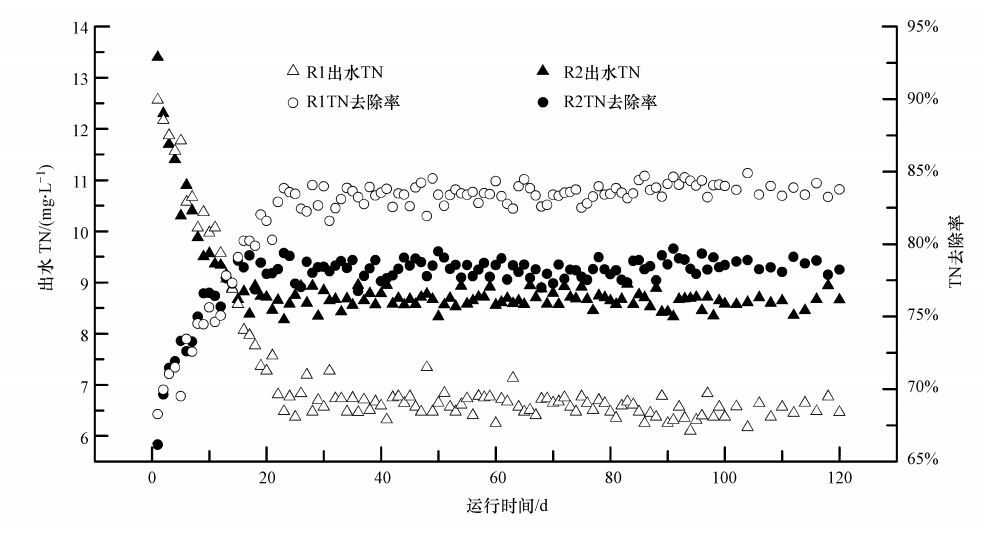
圖 4 R1和R2長期運行的脫氮效果
4 結論
在兩反應器進水乙酸鈉、氨氮(NH+4-N)及磷酸鹽(PO3-4-P)濃度均分別為350 mg · L-1(以COD計)、40 mg · L-1及12 mg · L-1,水力停留時間(HRT)為12 h時,對比研究了靜置/好氧/缺氧SBR(R1)與厭氧/好氧/缺氧SBR(R2)的生物脫氮除磷性能. 結果發現,靜置段可起厭氧段作用,這為生物強化除磷奠定了基礎;靜置/好氧/缺氧SBR的 SOP和TN去除率分別為92.4%和83.5%,厭氧/好氧/缺氧SBR的SOP和TN去除率分別為92.1%和77.0%;以靜置段代替厭氧段的靜置/好氧/缺氧SBR可達相當的除磷效果,而由于R1同步硝化-反硝化脫氮量及后置反硝化脫氮量均較R2多,故其脫氮效果更好.該設置在避免污泥回流的基礎上省卻厭氧攪拌而簡化工藝,降低了處理成本.