氮磷污染物[1-2]處理方法主要分化學沉降法、物理化學法和生物法[3-5]。化學沉淀法廣泛應用于污水處理中,姜翠玉等[6]利用反滴加- 化學共沉淀法合成了 Fe3O4 水基磁流體用于油田污水的處理; Os-
manlioglu[7]使用亞鐵氰化鉀、硝酸鎳等藥劑利用兩級化學沉淀法凈化放射性廢水。筆者以高氮磷含量濾液為處理對象,通過添加鈣鎂復配新型藥劑進行除磷脫氮研究,考察 pH 值、鎂源、鈣鹽投加量等因素對污水除磷脫氮的影響。
1 實 驗
1. 1 實驗儀器與試劑
試劑: 氫氧化鈉 ( NaOH ) ,分 析純; 氯化鈣 ( CaCl2) ,分析純; 氫氧化鈣( Ca( OH) 2 ) ,分析純; 氯化鎂( MgCl2) ,分析純; 氧化鎂( MgO) ,分析純。
儀器: 實驗室pH 計( STARTER 3100 / B) ,奧豪斯公司; 精密電子天平( ME103-E) ,梅特勒-托利多; 立式自動電熱壓力蒸汽滅菌器( BXM- 30R) ,上海博訊醫療生物儀器股份有限公司; 紫外可見分光光度計 ( UV-1800) ,島津; 六聯電動攪拌儀( JJ-6D) ,金壇市億能儀器廠; 高效率數控超聲波清洗器( KQ - 400KDE) ,昆山市超聲儀器有限公司; 電熱恒溫振蕩水槽( DK-2-2) ,上海精宏實驗儀器有限公司。
1. 2 實驗方法
取 1 L 污水于燒杯中,測定總磷( TP ) 、總氮 ( TN) 和 NH3 - N 質量濃度分別為 3. 87、24. 41 和
15. 76 mg / L,pH 值為 7. 84。向水樣中投入鎂鹽,用
攪拌儀攪拌 3 min。投入一定質量的 NaOH,快速攪拌 5 min,后慢速攪拌 30 min; 向污水中添加鈣鹽,慢速攪拌 30 min,反應完成后,靜置沉淀 1 h,取上清液進行 NH3 -N、TP 和 TN 的測定。
NH3 -N 質量濃度采用納氏試劑分光光度法測 定,參照 HJ 535- 2009 方法執行; TP 采用鉬酸銨分光光度法測定,參照 HJ 671- 2013 方法執行; TN 采用堿性過硫酸鉀消解紫外分光光度法測定,參照 HJ
636-2012 方法執行。pH 值采用玻璃電極法測定,參照 GB 6920-86 方法執行。
2 結果分析
2. 1 NaOH 投加量對除磷脫氮的影響
NaOH 投加量影響到污水 pH 值的變化,pH 值是影響除磷脫氮效果的關鍵因素,以鎂鹽為藥劑形成磷酸銨鎂沉淀方程式如下:
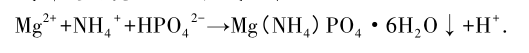
在形成沉淀的過程中會產生 H+ ,使污水 pH 值降低,加入 NaOH 后,反應產生的 H+ 被 OH- 反應去除,使反應向沉淀產生的方向進行,從而提高除磷脫氮的效率[8]。本文中實 驗以 NaOH 作為 pH 調節劑;
MgCl2 為除磷劑,投加量分別為 40、60、80 mg / L。結果表明: NaOH 質量濃度分別為 0、50、100、150、200、 250 和 300 mg / L 時,pH 值分別為 7. 84、8. 68、9. 15、 9. 27、9. 39、9. 45 和 9. 69。除磷脫氮效果見圖 1。
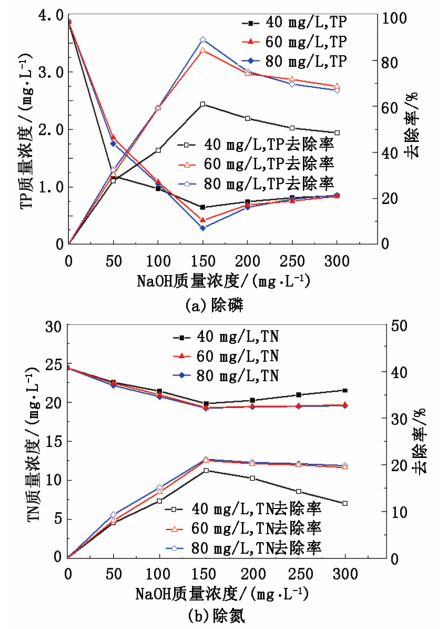
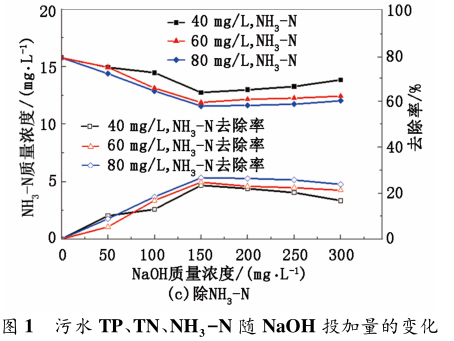
隨 NaOH 投加量的增加,pH 值呈現緩慢增長而非線性增加,原因是污水中含有大量的金屬離子,會與投入的部分 NaOH 發生絡合反應,使 加入的 NaOH 不能完全用于改變 pH 值。NaOH 與金屬離子( Mn+) 發生絡合反應方程式如下:
絡合反應形成的微量沉淀物可以作為晶種,破壞溶液的亞穩態,降低磷酸銨鎂結晶的活化能,使結晶速率得到提高,促進除磷脫氮。由圖 1 可看出,隨
NaOH 投加量的增加,以 MgCl2 為除磷劑,氮磷的去除率隨 pH 的升高先增大后降低,其原因是在一定的 pH 值范圍內,NaOH 的加入促進了磷酸銨鎂沉淀的形成,去除率隨 pH 值的升高而增大[9]; 而在高pH 條件下 Mg2+ 會優先生成 Mg( OH) 沉淀,影響磷酸銨鎂沉淀的形成; 且當體系 pH 值過高時,溶液中的大部分 NH4 轉化為 NH3 ·H2O,在一定溫度下轉化為氨氣逸出,使溶液中 NH4 質量濃度降低,影響磷酸銨鎂沉淀的形成,從而使得除磷脫氮的效果降低。當 NaOH 的投加量為 150 mg / L,MgCl2 投加量為 60 mg / L 時,處理后具體聯系污水寶或參見http://www.bnynw.com更多相關技術文檔。 TP 質量濃度為 0. 41
mg / L,TN 質量濃度為 23. 68 mg / L,NH3 - N 質量濃度為 13. 92 mg / L,此時除磷脫氮效率均達到最高,除磷率為 84. 32%,脫除 TN 效率為 20. 89%,脫除NH3 -N 效率為 24. 68%,其中 TP 含量達到國家污水處理一級 A 標準。
2. 2 鎂源對除磷脫氮的影響
|
+ 3- |
6H2O) 沉淀,從而可以達到同時除去污水中氨氮和磷酸鹽形成 MAP ( 鳥糞石) 沉淀的目的,方程式如下[10]:
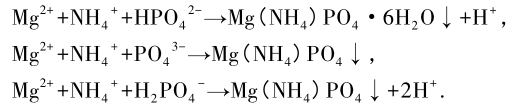
在 NaOH 投加量為 150 mg / L,污水 TP、TN 和NH3 -N 質量濃度分別為 3. 87、24. 41 和 15. 76 mg / L 條件下進行實驗,結果見圖 2。圖 2 看出,隨鎂源投加量的增加,污水 TP 的質量濃度逐漸降低,去除率在投加量為 60 mg / L 時基本不變; TN 質量濃度隨投加量的增加逐漸降低,去除率逐漸升高; NH3 - N 呈降低趨勢,去除率在投加量超過 60 mg / L 不再變化。出現該現象的原因是鎂源的增多對污水除磷脫氮起促進作用。當 Mg2+質量濃度達到一定,晶粒逐漸產生,沉淀反應正向進行。在一定的 TN、TP 質量濃度下,當 PO4 、NH4與 Mg2+ 的離子活度積大于 MAP 的濃度積時,晶體成核發生,因離子在晶核表面沉淀的活化能較成核 所需活化能更低,晶體生長速率更快,晶體開始生長。溶液中的鎂離子質量濃度越高,平衡向沉淀產生方向移動,反應接近完全,TP 的去除作用越明顯;當鎂源投加量為 60 mg / L 時,磷酸銨鎂微溶于水,此時PO4 、NH4 與 Mg 質量濃度達到該溫度下的沉淀平衡,但過量增大鎂鹽投加量會使溶液中 Mg2+ 和PO4 發生副反應生成 Mg3 ( PO4 ) 2 的趨勢增大,從而使氨氮的脫除效果降低。繼續投加鎂源,除磷脫氮效率無顯著增加。MgCl2 與 MgO 對比之后可以發現,前者的效果要優于后者,由于所處理污水原水pH 值為 7. 84,呈弱堿性,且 MgO 在堿性環境下溶解度小,在沉淀反應開始前未完全溶解,生成的 MAP沉積在未溶解的 MgO 表面,導致部分 MgO 被 MAP包裹在內部而無法與溶液充分接觸,使反應不完全,因此 MgO 對于除磷脫氮的作用有限[11]。基于對成本和 藥 劑 需 求 量 考 慮,以 NaOH 質 量 濃 度 為 150 mg / L,MgCl2 質量濃度為 60 mg / L 為最佳投藥量。
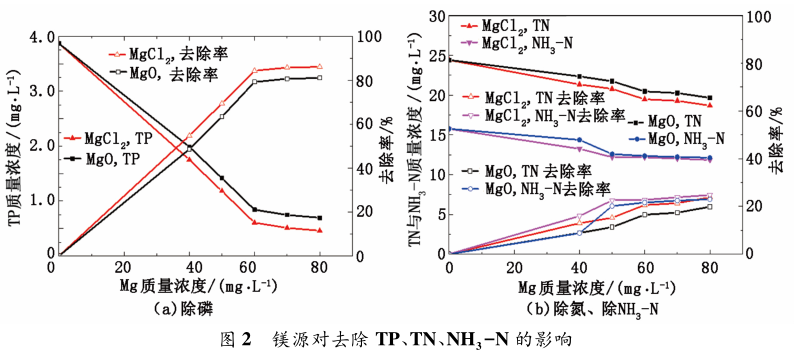
在污水中單獨添加鎂源對除磷脫氮有一定作用,為保證高去除率,防止污水指標波動對進出水造成沖擊,添加鈣鹽與鎂鹽復配,在控制磷含量基礎上,繼續提高磷的去除率。在污水 TP 質量濃度為2. 87 mg / L、TN 質量濃度為 24. 41 mg / L、NH3 - N 質量濃度為 15. 76 mg / L,CaCl2 質量濃度為 80 mg / L的條件下進行實驗,結果見圖 3。
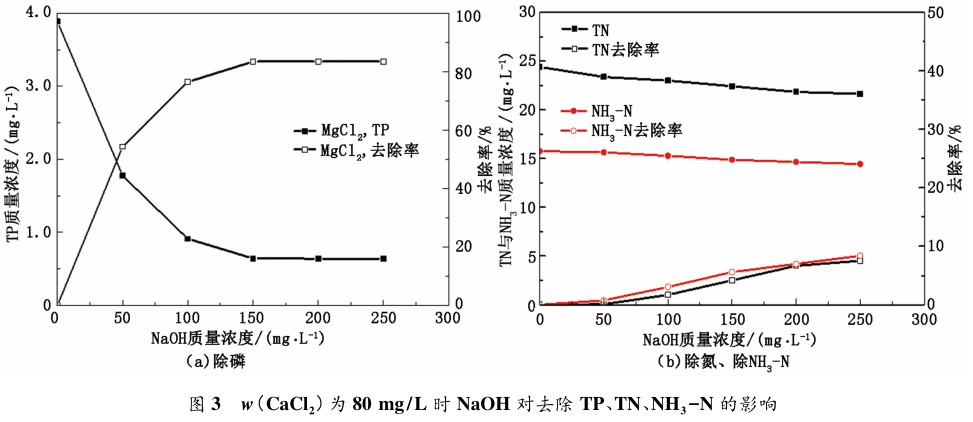
從圖 3 可知,CaCl2 質量濃度為 80 mg / L 時,NaOH 投加量由 50 mg / L 增加至 250 mg / L 時,污水TP 含量逐漸降低,當 NaOH 質量濃度為 150 mg / L時,TP 趨于穩定,除磷率為 83%。其原因是羥基磷酸鈣隨 pH 的增加溶解度降低; 從羥基磷酸鈣的方程式中可以看出,當溶液中的磷元素以 PO4 形式存在時,沉淀才會產生,從而達到除磷的目的。而水中磷元素的存在形式有 H2PO4 、HPO4 、PO4 ,隨pH 值的逐漸增加,PO4 所占分數越大,越有利于磷酸羥基鈣的形成[13]。且當溶液 pH 值過高時,Ca2+會與OH- 結合形成Ca( OH) 沉淀,從而影響羥基磷酸鈣的形成,使除磷率沒有得到進一步的提高。當NaOH 質量濃度為 150 mg / L 時,pH 值約為 9. 2,此時 PO4 所占分數趨于平穩,TP 去除率穩定為77. 2%。然而 NaOH 的投加量增多,pH 值升高會造成污水堿度過高,故以下實驗 NaOH 質量濃度固定在 150 mg / L。
2. 3. 2 CaCl2 投加量
污水 TP 質量濃度為 3. 87 mg / L、TN 質量濃度為 24. 41 mg / L、NH3 - N 質量濃度為 15. 76 mg / L, NaOH 投加量為 150mg / L 時,改變 CaCl2 的投加量,結果見圖 4。
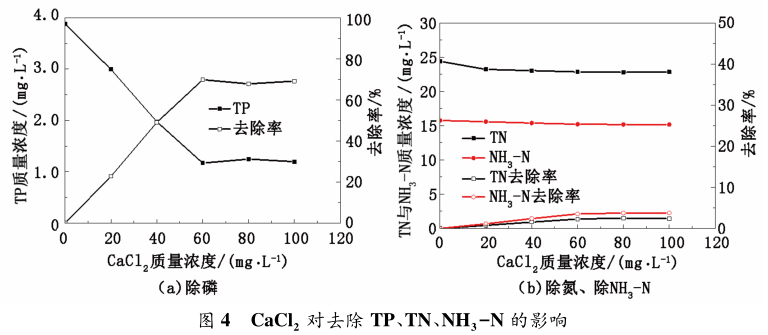
從圖 4 看出,隨 CaCl2 投加量的增加,TP 去除率達到 69%。由于原污水中的 TP 質量濃度高,處理后的TP 質量濃度為 1. 19 mg / L,未達到 0. 5 mg / L 以下,并未實現達標處理。當 Ca2+ 、PO 3- 、OH- 的質量濃度積達到磷酸羥基鈣 Ksp時,溶液過飽和析出結晶,形成沉淀。由實驗結果可知,鈣鹽法對 TP 有明顯作用,但對 TN 和NH3 -N 影響較弱。TN 和NH3 -N 略有降低的原因是產物羥基磷酸鈣作為一種沉淀吸附劑可以吸附周圍少量的銨根離子,但吸附能力有限。經過鈣鹽與鎂鹽研究可發現,當二者單獨投加量增加到一定值時,此時同種離子達到飽和,反應接近平衡,繼續投加藥劑,TP、TN、NH3 -N 質量濃度不再變化。為有效除磷脫氮,本實驗將鈣鹽與鎂鹽進行復配,探究鈣鎂最佳配比,實現除磷脫氮的最佳配方。
2. 3. 3 以 CaCl2 為變量與鎂鹽進行復配
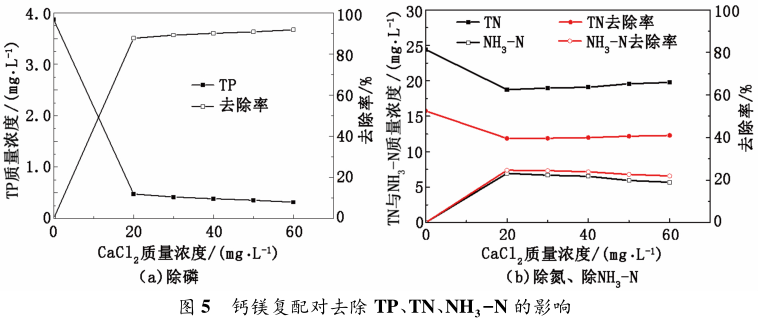
從圖 5 看出,在 NaOH 質量濃度為 150 mg / L,MgCl2 質量濃度為 60 mg / L 條件下,CaCl2 的質量濃度從 20 mg / L 升高到 60 mg / L 時,TP 從 3. 87 mg / L降至 0. 31 mg / L,去除率超過 90%,與單獨投加鎂鹽相比,去除率提高了 8%; 在 CaCl2 質量濃度升高的過程中,TN 和 NH3 - N 質量濃度出現先降低后升高的現象,出 現峰值時 TN 從 24. 41 mg / L 降 至 18. 97mg / L,NH3 -N 從 15. 76 mg / L 降至 11. 87 mg /L,去除率達到 25%。文獻[14]指出,Ca2+ 加入過多會導致 Ca2+ 摻入 MAP 晶體中,導致晶體結構改變,將生成的產物加熱后發現 Ca2+ 替代部分 Mg2+ ,形成共價化合物白化石( Ca,Mg) 3 ( PO4 ) 2,故加入過量CaCl2 會影響MAP 沉淀的產生進而影響TN、NH3 -N的去除。鈣鎂復配方法與鎂鹽法相比,除磷率提高了 90%。
2. 4 鈣鎂復配除磷動態試驗
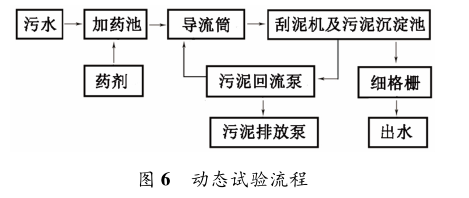
基于對鈣鎂復配靜態實驗的數據,在保證 TP、TN、NH3 -N 去除率的基礎上,為降低成本對藥劑量進行調整,現搭建一套小試裝置進行試驗( 動態試驗) ,考察 NaOH、MgCl2、CaCl2 投加量對除磷脫氮的影響,試驗流程見圖 6。
2. 4. 1 NaOH 投加量
在靜態實驗中利用 NaOH 作為 pH 調節劑,得知 pH 值與除磷脫氮的關系。在動態試驗中縮小pH 值范圍,確定適宜 NaOH 投加量。在污水 TP、TN、NH3 - N 質量濃度分別為 3. 87、24. 41 和 15. 76mg / L,MgCl2 投加量為 60 mg / L 條件下進行試驗,結果見圖 7。
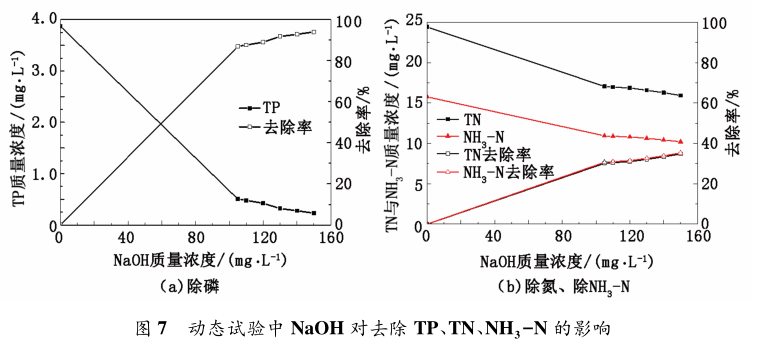
由圖 7 可知,隨 NaOH 投加量增多,TP 質量濃度逐漸降低,最低降至 0. 23 mg / L。當 NaOH 質量濃度為 105 mg / L 時,TP 質量濃度為 0. 48 mg / L,小于 0. 5 mg / L,已達到國家污水處理一級 A 標準,此時除磷率達到 84%; TN 可達到的最低質量濃度為 18 mg / L,當 NaOH 投加量為 105 mg / L 時,TN 質量濃度為 19. 3 mg / L,去除率達到 30%,NH3 -N 可達到的最低質量濃度為 15. 92 mg / L,其中當 NaOH 投加量為 105 mg / L 時,NH3 -N 質量濃度為 17. 05 mg / L,去除率為 30%; 為控制成本,選取 NaOH 投加量為 105 mg / L,此時 TP 已達到國家標準,TN 和 NH3 -N去除率達到 30%。動態試驗中 NaOH 最佳投加量小于靜態實驗,是因為在靜態試驗中使用的是固體NaOH,影響離子結合的速度,造成局部質量濃度過高,不利于反應進行,在動態試驗中將 NaOH 配制溶液,有利于離子結合,加快反應速度,促進反應進行。
2. 4. 2 MgCl2 投加配比
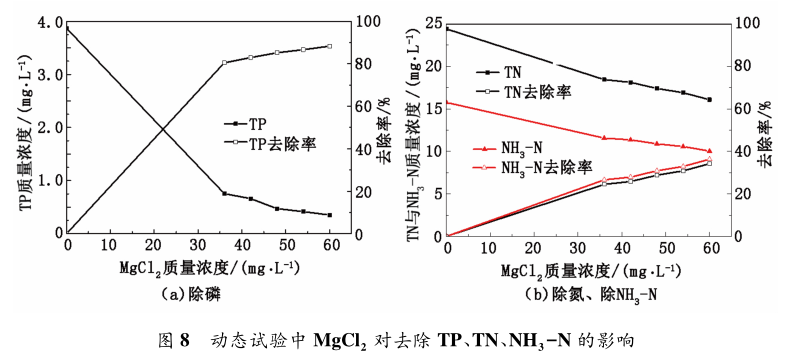
為了調整動態試驗中各項藥劑的配比,降低成本,在一定 NaOH 投加量下,考察 MgCl2 投加量對污水除磷脫氮效果的影響。在 NaOH 質量濃度為 105mg / L,污水 TP 質量濃度為 3. 87 mg / L、TN 質量濃度為 24. 41 mg / L、NH3 -N 質量濃度為 15. 76 mg / L 條件下進行,結果見圖 8。
從圖 8 看出,隨 MgCl2 投加量的增多,TP、TN、NH3 - N 質量濃度逐漸降低,去除率升高,此結論與靜態實驗一致; TP 質量濃度最低降至 0. 35 mg / L,TN 質量濃度最低降至 16. 08 mg / L,NH3 - N 質量濃度最低降至 10. 03 mg / L。在 MgCl2 投加量為 48mg / L 時,TP 質量濃度為 0. 412 mg / L,去除率為85%; TN 質量濃度為 17. 4 mg / L,去除率為 28%;
NH3 -N 質量濃度為 10. 89 mg / L,去除率為 30%。在動態實驗中,氯化鎂最佳投加量較靜態實驗較低,其原因是試驗過程中將氯化鎂配制成溶液,有利于離子自由移動,促進 Mg2+ 參與反應,加快了磷酸銨鎂晶體結晶速度,利于反應進行。由此可見,當 NaOH質量濃度為 105 mg / L,MgCl2 投加量為 48 mg / L 時,T 已達到國家污水處理一級 A 標準,而且氨氮去除率達到 30%。
2. 4. 3 CaCl2 投加配比
基于靜態實驗中所用的鈣鎂復配法除磷脫氮效率較高,對于動態試驗中的各項藥劑配比需進行重新調整,在實現磷達標的基礎上,降低成本。在NaOH 和 MgCl2 質量濃度分別為 105 和 48 mg / L,改變 CaCl2 的質量濃度,在污水 TP、TN 和 NH3 - N 質量濃度分別為為 3. 87、24. 41 和 15. 76 mg / L 條件下進行試驗,結果見圖 9。
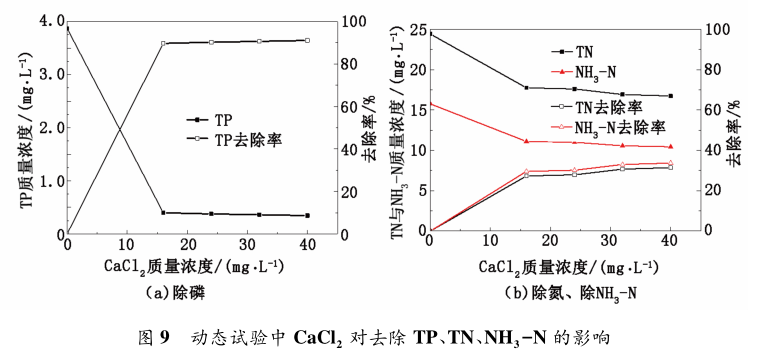
由圖 9 看出,隨 CaCl2 投加量的增加,TP 質量濃度逐漸降低,除磷率升高,TN、NH3 -N 變化并不明顯。與鎂鹽法相比除磷率有所提高,TP 質量濃度從2. 87 mg / L 降到 0. 34 mg / L,達到國家標準,并且去除率達到 90% 以上。TN、NH3 - N 去除率達到 30%以上; 在 CaCl2 質量濃度為 24 mg / L 時,除磷率已90%,氨氮去除率達到 30%,考慮到成本問題,在動態試驗中,鈣鎂復配配方中 NaOH、MgCl2、CaCl2 的質量濃度分別調整為 105、48 和 24 mg / L。
3 結 論
( 1) 使用鈣鎂復配藥劑對高氮磷含量污水的除磷脫氮實驗中,NaOH、MgCl2和 CaCl2的質量濃度分別為 150、60 和 40 mg / L 時,TP 去除率達到 90%,TN 和 NH3 -N 去除率達到 25%。
( 2) 動態試驗中,NaOH、MgCl 和 CaCl 的投加量分別為 105、48 和 24 mg / L 時,TP 去除率達到90%,TN 和 NH3 -N 去除率均達到 30%。
( 3) Ca2+ 和 Mg2+ 在一定條件下與 PO- 、NH+等基團發生反應,生成磷酸銨鎂以及羥基磷酸鈣沉淀,從而達到除磷脫氮效果。(來源:中國石油大學學報)