N2O是強溫室氣體,同時也是可再生能源,當其替代O2與甲烷燃燒時可以提高熱值,還可以用于醫學、工業以及半導體行業等。由于污水處理過程是N2O釋放的重要人為來源,因此生物脫氮過程中N2O的富集成為研究熱點之一。食品加工、制造及釀酒等行業會產生大量酸性有機含氮廢水,在反硝化脫氮之前,常需加堿進行預處理,這會增加系統的復雜性與運行費用。研究酸性條件下反硝化的性能,可為此類廢水的直接處理提供依據。已有研究表明,酸性條件和游離亞硝酸(FNA)濃度是影響反硝化過程中N2O產率的重要因素。Thörn等研究發現,在酸性條件下,40%以上的NOx-會以N2O的形式積累。Pan等研究恒定pH對反硝化的影響時發現,當pH為6.0時,N2O的釋放率高達40%。有學者推測酸性條件下產生的FNA通過抑制N2O還原酶的活性增加N2O的釋放。由于FNA是酸性條件下NO2-質子化的結果,真正的抑制劑仍需進一步明確。
NO2-型反硝化是順序反應的過程,依次由亞硝酸鹽還原酶(NIR)、NO還原酶(NOR)和N2O還原酶(NOS)將NO2-還原為NO、N2O和N2。作為中間產物,N2O的凈產率同時受其產生和還原的影響,研究酸性條件下N2O的還原特性可為其富集機理提供依據。由于N2O是溶解性氣體,傳統測定方法存在困難,而微電極可連續測定其濃度的變化,這就為其檢測提供了有效手段。
筆者以NO2-型反硝化活性污泥為研究對象,分析了SBR系統在酸性進水條件下的反硝化運行特征和N2O釋放行為,并探討了影響N2O還原速率的因素,旨在揭示酸性條件下N2O積累的機理,并為生物反硝化過程中N2O的富集回收提供依據。
1、材料與方法
1.1 試驗裝置
連續試驗采用SBR裝置,其有效容積為0.6L,排水比為0.33。每天運行4個周期,單周期為6h,即進水5min、攪拌240min、沉淀60min、排水5min、閑置50min。采用磁力攪拌方式,在室溫條件下運行,水溫為20~25℃。
批式試驗反應器的有效容積為0.6L,使用N2進行吹脫(氮氣流速為0.2L/min)以實現泥水完全混合,并將產生的N2O吹脫出來。
1.2 污泥來源和試驗用水
試驗所用污泥為課題組前期馴化完成的NO2-型反硝化污泥,其整體為黃褐色絮體,MLVSS/MLSS約為0.8,采用酸性廢水進行馴化,進入反應器污泥的初始pH為5.5,反應器中污泥濃度約為4000mg/L,每天排混合液,控制泥齡約為15d。
采用人工配制試驗用水,其由乙酸鈉、亞硝酸鈉和微量元素組成,微量元素按文獻配制,投加量為1mL/L。運行階段NO2--N濃度控制在100~120mg/L,保持C/N為3。
1.3 試驗方案
連續運行及典型周期試驗:SBR正常運行過程中,連續監測進出水COD、NO2-的濃度及N2O釋放量。定期分析典型周期碳、氮轉化及N2O釋放特性。
酸性pH及FNA對N2O釋放的影響:取0.2LSBR中的污泥,洗泥3次后置于批式反應系統中,采用人工配水進行試驗,反應時間為4h,反應溫度控制在22℃。每10min采集一次氣體測定N2O濃度,每30min采集一次液體測定NO2-和COD濃度,試驗結束后測定MLSS和MLVSS濃度。pH影響試驗中,初始NO2--N濃度為80mg/L,以0.2mol/L的HCl或NaOH保持系統內pH恒定,分別在pH為5.0、5.5、5.8、6.0、6.5、7.0的條件下進行試驗,pH的變化幅度不超過±0.1。FNA影響試驗中,控制反應中pH恒定為5.8,通過添加不同濃度的NO2(-10、30、40、50、70、90mg/L)使FNA的初始濃度分別為0.16、0.44、0.68、0.84、1.16、1.54mg/L。
酸性pH及FNA對N2O還原速率的影響:通入N2O標準氣體配制飽和溶液,稀釋65倍,配制初始濃度為10μmol/L的水溶液(a溶液)備用。a溶液在不同pH(5.5~7.0)條件下以N2O為基質進行批式試驗。a溶液中加入少量亞硝酸鹽制成b溶液,在不同pH(5.5~7.0)條件下形成不同FNA濃度進行批式試驗。反應時間為15min,通過水浴加熱控制溫度為(20±1)℃。用N2O微電極測定N2O濃度,試驗結束后測定MLSS和MLVSS,并計算還原速率。
1.4 分析項目及方法
COD采用重鉻酸鉀法測定;亞硝酸鹽采用N-(1-萘基)-乙二胺光度法測定;硝酸鹽采用紫外分光光度法測定;MLSS、MLVSS采用重量法測定;溶解性N2O利用微電極測定,測定前進行校準。
N2O氣體的采集:批式試驗產生的N2O氣體用氮氣進行吹脫,使用50mL注射器在反應器上部集氣區采集氣體樣品,用氣相色譜儀進行測定。氣體分析與計算:利用PE600氣相色譜儀對樣品中的N2O濃度進行分析。N2O的釋放速率和釋放量參考Kong等、Kimochi等的方法進行計算。
2、結果與討論
2.1 酸性進水條件下NO2-型反硝化的運行特性
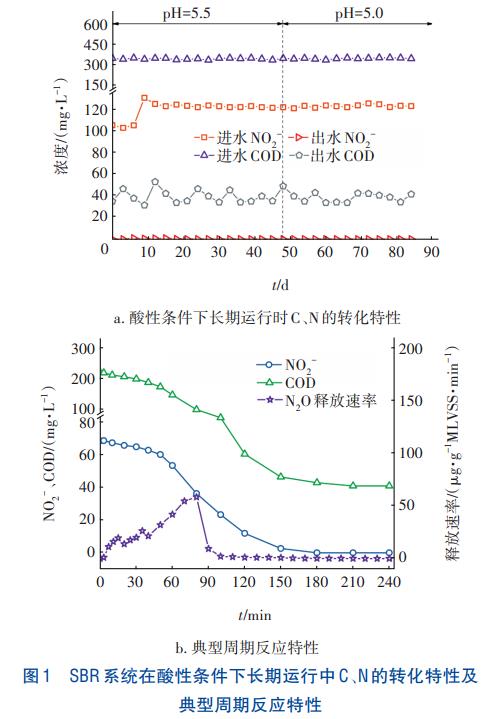
課題組前期馴化得到適應酸性條件(pH=5.5)的NO2-型反硝化活性污泥,接種后再次降低進水pH至5.0并使其穩定,研究酸性條件下NO2-型反硝化的運行特性,并在80d時分析了SBR反應器典型周期內C、N轉化及N2O釋放特性,結果如圖1所示。由圖1(a)可以看出,NO2-型反硝化在酸性條件下運行穩定。當初始pH為5.0時,出水NO2--N濃度為0~0.8mg/L,其去除率大于99%;出水COD為33~51mg/L,其去除率為86.1%~90.9%。經計算,去除的C/N在1.98~2.60之間。由圖1(b)可以看出,隨著反應的進行,NO2-和COD均隨時間的增加呈降低趨勢。經計算,NO2-的還原速率為10.88mg/(gMLVSS·h),消耗的C/N為2.28。N2O的釋放主要發生在前90min,最大釋放速率為58.27μg/(gMLVSS·min),有7.17%的NO2-轉化為N2O,釋放速率隨時間呈先升后降的趨勢。
2.2 pH對NO2-型反硝化及N2O轉化特性的影響
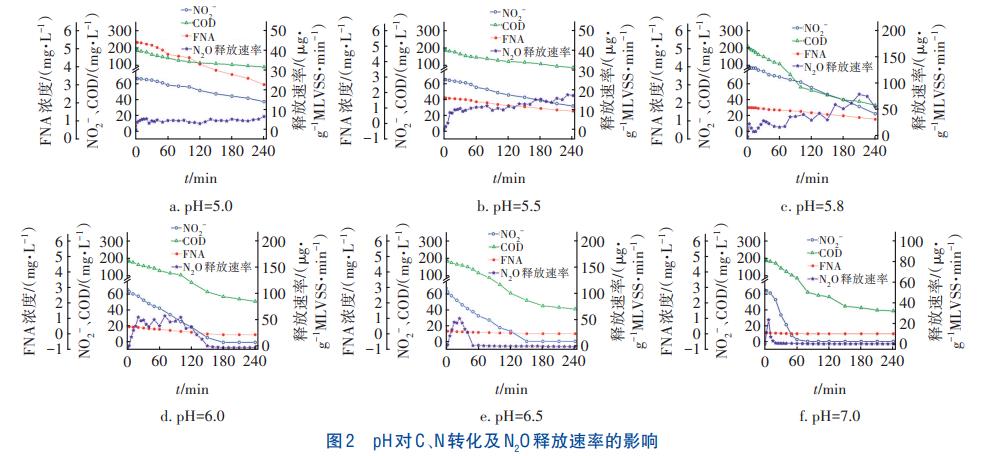
pH對C、N轉化及N2O釋放速率的影響如圖2所示。可以看出,在不同pH條件下,NO2-和COD濃度均隨時間的增加呈下降趨勢,但反硝化速率不同。當pH為7.0時,60min內完成了NO2-的還原,但N2O的釋放主要發生在前30min。隨著pH由5.8降至5.0,出水NO2-濃度呈升高趨勢。當pH為5.0時,NO2-去除率僅為43.3%。不同pH條件下,N2O釋放呈現不同的特點。當pH分別為7.0、6.5時,N2O的釋放速率隨時間呈先升高后降低的趨勢,且主要發生在反應前期,分別在第10、25分鐘達到釋放速率峰值。當pH為6.0時,N2O釋放速率呈先升后降的趨勢,在20~100min保持較高的釋放速率并出現了4個較明顯的釋放速率峰值。當pH≤5.8時,N2O釋放速率隨時間增加呈先上升后趨于穩定的趨勢。
不同pH條件下N2O的釋放特性見圖3。
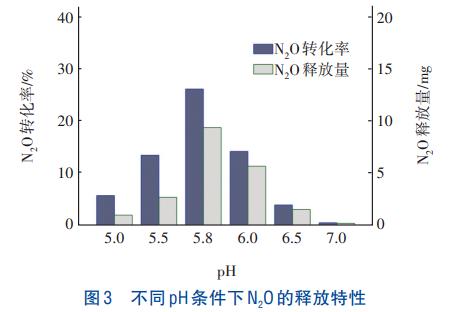
從圖3可知,酸性條件對NO2-還原速率及N2O釋放量與轉化率的影響顯著。經計算,隨著pH的降低,NO2-還原速率明顯下降,pH為7.0時NO2-還原速率是pH為6.5的2.3倍。當pH降至5.0時,還原速率僅為7.0時的11.67%,表明酸性環境對反硝化具有抑制作用。由圖3可知,隨著pH的降低,N2O轉化率和釋放量均呈先升高后降低的趨勢,N2O轉化率在pH為5.8時達到最大,為26.26%;當pH降至5.0時,N2O轉化率降至5.78%。呈現這種規律的原因可能是,以NO2-為電子受體時,較低的pH對系統中NIR、NOR、NOS的活性產生了不同程度的影響。
彭永臻等的研究表明,pH對于以NO2-為電子受體的反硝化過程影響顯著,除pH本身外,產生的FNA也會影響C、N的轉化特性。由圖3還可以發現,當pH由7.0降至5.0時,NO2-還原速率大幅降低,表明在酸性條件下NIR活性受到抑制,且pH越低抑制程度越嚴重。同時,酸性條件下NO2-的積累產生了較高濃度的FNA,然而N2O的釋放量和轉化率并未隨著pH的降低呈單向升高的趨勢,因此pH低于5.8時,很可能是pH及FNA對NOR的抑制更嚴重,導致N2O凈產量下降。有研究報道,在以NO2-為電子受體時,FNA是N2O還原酶的主要抑制劑。因此,分析相同pH、不同FNA濃度條件下NO2-還原及N2O釋放特征有助于探明FNA對NO2-型反硝化的影響。
2.3 FNA對NO2-型反硝化及N2O轉化特性的影響
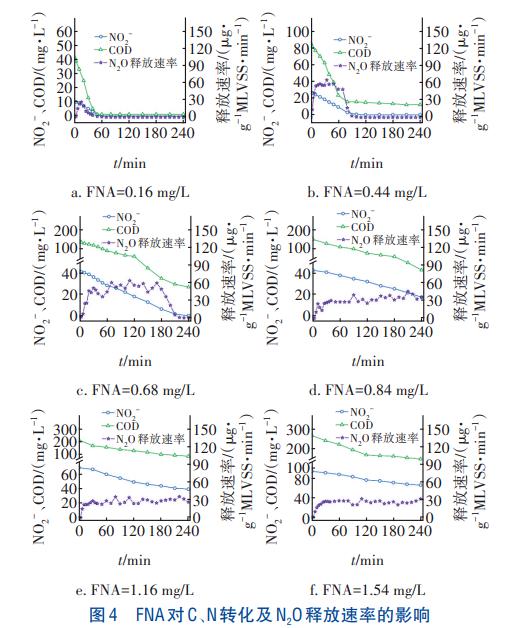
FNA對C、N轉化及N2O釋放速率的影響如圖4所示。可知,隨著FNA濃度的升高,COD和NO2-濃度均隨反應時間呈下降趨勢,但NO2-還原速率呈先升后降的趨勢,由4.03mg/(gMLVSS·h)(FNA濃度為0.16mg/L)升至5.34mg/(gMLVSS·h)(FNA濃度為0.44mg/L),然后逐漸降至2.30mg/(gMLVSS·h)(FNA濃度為1.54mg/L)。此外,不同FNA濃度下的N2O釋放速率不同。低FNA濃度(0.16~0.68mg/L)時,N2O釋放速率隨時間的增加整體呈先升高后降低的趨勢,且N2O的釋放時間隨FNA的升高而增加。高FNA濃度(0.84~1.54mg/L)時,N2O釋放速率在整個反應過程中均維持較高水平。經計算,N2O轉化率隨FNA的升高呈先升后降的趨勢,當FNA=0.84mg/L時,達到最大值42.56%。
FNA是NO2-質子化的結果,改變pH或NO2-濃度均影響FNA濃度。將兩種條件下(酸性pH和NO2-濃度的變化)的FNA濃度與NO2-還原速率和N2O轉化率進行了線性擬合,結果如圖5所示。可知,FNA濃度在特定區間內與NO2-還原速率具有線性負相關關系,與N2O轉化率具有線性正相關關系,但是進一步升高FNA濃度則降低了N2O產率。由圖5(a)可知,pH改變時FNA濃度在0.169~1.641mg/L區間與NO2-還原速率具有線性負相關關系,相關系數為0.9833。當初始FNA濃度為0.052、5.26mg/L時,NO2-的還原速率分別為25.28、2.95mg/(gMLVSS·h),表明FNA濃度低于一定水平,即pH較高時,其對NO2-還原速率的抑制作用微弱;當FNA濃度高出某一閾值,即pH較低時,其對NO2-還原速率的抑制作用增長不明顯。當FNA濃度處于0.052~1.031mg/L區間時,N2O轉化率與FNA濃度具有線性正相關關系,相關系數為0.9977,N2O轉化率在FNA為1.03mg/L時達到最大值26.26%;當FNA濃度繼續增至1.64、5.26mg/L(即pH分別為5.5和5.0)時,N2O轉化率降至13.54%、5.78%,表明過低的pH不利于N2O的富集。
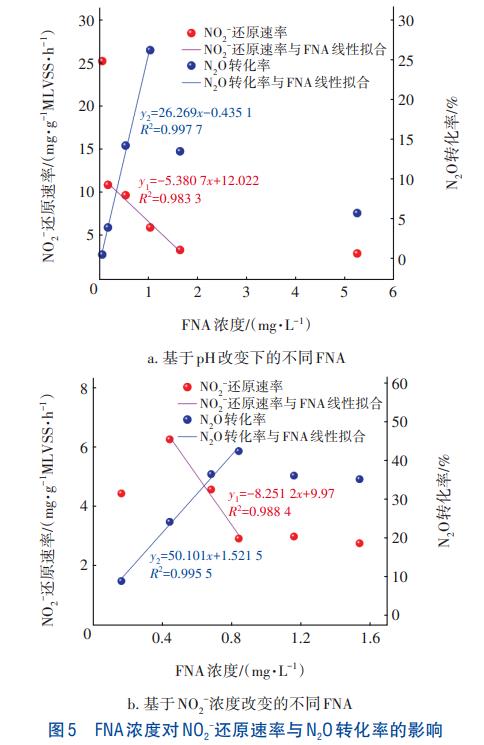
由圖5(b)可知,隨著FNA濃度的升高,N2O轉化率呈現先升后降的趨勢。當FNA處于0.44~0.84mg/L區間時,FNA濃度與NO2-還原速率具有線性負相關關系,相關系數為0.9884;當FNA濃度繼續增至1.16、1.54mg/L時,NO2-還原速率緩慢降至2.98、2.76mg/(gMLVSS·h),FNA濃度與NO2-還原速率突破原有的線性關系,表明過高的FNA濃度對NO2-還原的抑制作用快速減弱。當初始FNA濃度為0.16mg/L時,NO2-還原速率低于濃度為0.44mg/L時的還原速率6.26mg/(gMLVSS·h),推測原因是初始NO2-基質濃度過低所致。當FNA處于0.16~0.84mg/L區間時,FNA濃度與N2O轉化率具有線性正相關關系,相關系數為0.9955,因為FNA抑制NOS活性,導致N2O還原速率下降。當FNA濃度為0.84mg/L時,N2O轉化率達到最大值42.56%。當FNA濃度繼續增至1.16、1.54mg/L時,N2O轉化率降至36.20%、35.29%。
綜上所述,基于酸性pH或NO2-濃度改變所得FNA濃度均在一定區間內與N2O轉化率具有正相關關系,相關系數分別為0.9977和0.9955,進一步證明了酸性條件下FNA是NOS的主要抑制劑,與現有研究結論相一致。當FNA超過一定濃度或pH低于5.8時,N2O轉化率下降,表明過高的FNA濃度及過低的pH不利于N2O的富集。
2.4 pH和FNA對N2O還原速率的影響
pH和FNA對N2O還原速率的影響如圖6所示。從圖6(a)可以看出,當pH由7.0降至5.5時,N2O的濃度均呈降低趨勢。經計算,當pH為7.0和5.5時,N2O的還原速率分別為4.78×10-5和3.58×10-5g/(gMLVSS·min),后者較前者降低了25.1%。由圖6(b)可知,隨著pH從7.0降至5.5,N2O的還原速率同樣逐漸降低,由4.74×10-5g/(gMLVSS·min)降至3.01×10-5g/(gMLVSS·min),降低了36.5%。當加入少量NO2-,即存在FNA時,N2O還原速率均低于無FNA存在時的,當pH為6.0和5.5時尤為顯著。通過對比發現,pH和FNA都會抑制N2O還原酶的活性,且存在FNA時,抑制程度增強。而以單一N2O作為基質時,N2O消耗速率受影響較小,當添加了一定量NO2-后,隨pH的降低N2O消耗速率大幅下降,因此FNA濃度是NOS活性的主要抑制劑。
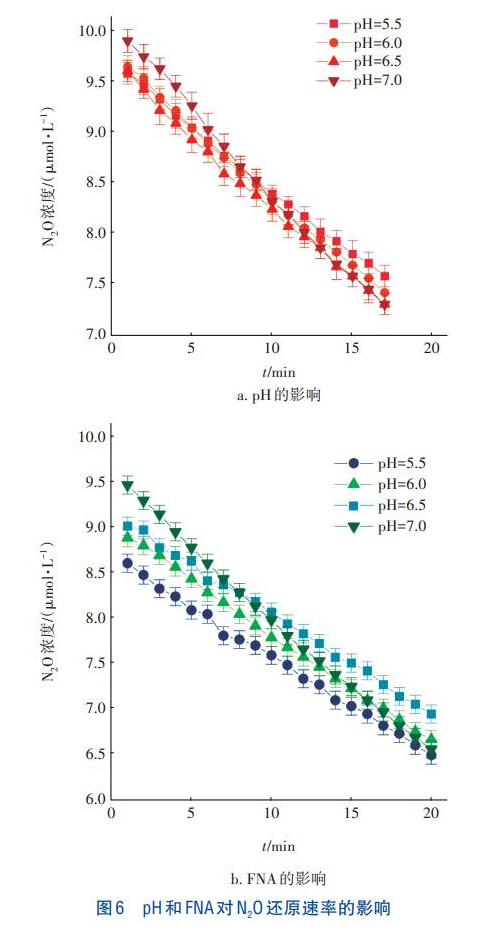
由圖3可知,隨著pH的降低,N2O轉化率和釋放量均呈先升高后下降的趨勢。由圖6(a)可知,以N2O為電子受體時,隨著pH的降低,N2O還原速率逐漸下降,因此當pH低于5.8時,N2O釋放量降低是pH抑制NOR所致,即過低的pH降低了N2O的產生。Field等發現,N2O合成酶的最適pH為6.0,這與本試驗結果一致。同理,FNA濃度對N2O轉化率和釋放量的影響類似,較高FNA濃度下,N2O釋放量降低也是因FNA抑制NOR所致。
3、結論
①利用微電極研究了酸性條件(5.5~7.0)對N2O還原的影響,發現N2O的還原速率隨pH的下降及FNA濃度的升高呈降低趨勢,且存在FNA時降低幅度增大,表明酸性條件及FNA均可抑制NOS活性,且后者是主要抑制劑。
②NO2-還原速率隨pH降低而下降,而N2O轉化率先升后降,當pH為5.8時可獲得最大轉化率,證明過低的pH會抑制NOR活性,導致N2O產量減少。
③在pH為5.8、FNA為0.16~0.84mg/L條件下,N2O轉化率與FNA濃度具有正相關關系,而過高的FNA濃度會抑NOR活性,導致N2O產量下降。(來源:中國市政工程華北設計研究總院有限公司西安分公司,西安建筑科技大學環境與市政工程學院,、陜西省膜分離技術研究院陜西省膜分離重點實驗室)



