N2O 是強力溫室氣體, 其溫室效應是CO2的200~300 倍。據統計,全球每年在污水處理過程中排放的N2O 為0.3×1012~3.0×1012 kg, 占全球N2O 排放總量的2.5% ~25%〔1〕。由于污水處理的多樣性和復雜性,有效控制污水處理過程中N2O 的排放任重而道遠。
污水脫氮中的N2O 排放是微生物與其周圍環境共同作用的結果, 環境條件和微生物之間是內外因關系,環境因素通過微生物影響N2O 排放。研究表明,參與污水脫氮的微生物(如硝化菌、反硝化菌等)在N2O 的產生能力上存在較大差異〔2-3〕。如果某污水脫氮系統中微生物群落由N2O 產生能力強的菌組成,那么該系統的N2O 排放量就可能高,反之亦然。這是污水脫氮中微生物群落影響N2O 排放的可能途徑。近年來, 為了有效控制污水脫氮中N2O的排放,國內外學者圍繞pH、DO、C/N、泥齡、底物濃度等不同環境因素對N2O 排放的影響進行了一些研究〔4-5〕。但迄今為止,很少涉及到污水脫氮中微生物群落對N2O 排放的影響。
筆者在不同NH4+濃度下研究了系統氮素轉化效率與微生物群落對N2O 排放的影響,以期為有效控制污水處理中N2O 的排放提供參考。
1 材料與方法
1.1 實驗裝置及工藝
實驗采用內徑260 mm、高360 mm 的圓柱形SBR 反應器,其有效容積為15 L。以黏砂塊作為微孔曝氣器, 采用鼓風曝氣, 以轉子流量計控制曝氣量。
1.2 種子污泥及實驗用水
種子污泥取自當地某制藥廠污水處理池。研究采用模擬污水, 模擬污水由葡萄糖、(NH4)2SO4、NaHCO3、NaCl、CaCl2、KH2PO4、MgSO4·7H2O 配制而成。模擬污水的pH 為7 左右, 反應過程中不再調pH。
1.3 污泥馴化及實驗方法
將2 000 mg/L 的種子污泥置于SBR 反應器,在室溫條件下進行馴化, 實驗期間水溫為25~28 ℃。SBR 系統的實驗工序為瞬時進水0.5 h、曝氣攪拌5 h、缺氧攪拌2 h、沉淀排水1 h 及閑置,每天運行1~2 個周期。曝氣階段的曝氣強度為2.5 L/min。污泥馴化階段,好氧硝化段進水NH4+為40 mg/L,COD 為400 mg/L,缺氧反硝化段補充加入COD 200 mg/L。經過40 d 左右的馴化,當污泥質量濃度達到4 000mg/L 左右, 總氮和COD 去除率穩定達到95%以上時,認為污泥馴化結束。
當系統穩定運行時,在NH4+質量濃度為20、40、60 mg/L 的條件下, 分析了氮素轉化過程中的N2O排放及微生物群落特征。其他條件和污泥馴化時的工藝條件相同。
1.4 反應氣采集及N2O濃度測定
SBR 工藝曝氣階段, 從氣體排放口中直接采集反應氣;缺氧反硝化段,以吹出的方式采集反應器中液體表面的反應氣。
氣樣中N2O 的濃度用氣相色譜儀電子捕獲檢測器(ECD)進行檢測。檢測條件:柱溫40 ℃、進樣口溫度60 ℃、檢測器溫度330 ℃,柱子采用Porapak Q毛細管柱, 載氣為純氮。實驗中,N2O 標準氣(5.27μmol/mol)由南京麥克斯公司提供。
1.5 其他化學指標分析
污水COD、NH4+-N、NO3--N、NO2--N 等指標的測定采用國家環境保護總局發布的標準方法〔6 〕。1.6 微生物群落分析實驗采用PCR-DGGE(Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoreses)方法,分析不同NH4+-N 濃度下的微生物群落特征。污泥樣品前處理、總DNA 提取及純化按文獻〔7〕的方法進行。使用通用引物P2(5’-ATTACCGCGGCTGCTGG-3’) 和P3 (5’ -CGCCCGCCGCGCGCGGCGGGGGGGGGGGCACGGGGGGCCTACGGGAGGCAGCG-Ag-3’)擴增基因組總DNA 16S rDNA V3 區,PC 擴增體系和程序見文獻〔8〕。聚丙烯酰胺的變性梯度范圍為35%~60%,DNA 擴增產物上樣量為200 ng 左右。200 V 電壓下,1×TAE 緩沖液中電泳240 min。電泳完畢后,用0.5 mg/L 的溴化乙錠染色,上UVI 成像系統成像。所得圖像用BIO-RAD QUANTITYONE 4.0 軟件進行分析。
2 結果與分析
2.1 氮素轉化與N2O 排放
不同NH4+濃度下SBR 系統中的總氮變化如圖1 所示。
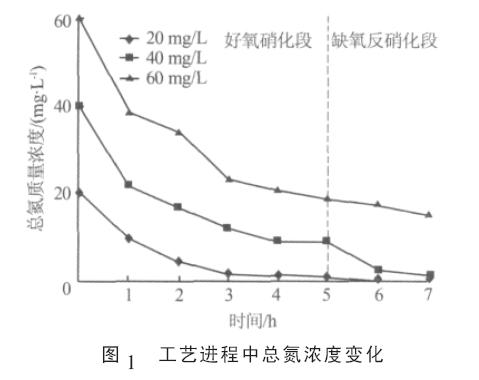
由圖1 可見, 當NH4+質量濃度為20、40 mg/L時,總氮被有效去除,總氮去除時期分別為第3 小時和第7 小時;而當NH4+質量濃度為60 mg/L 時,在整個脫氮周期內總氮去除率只有75%左右。
工藝進程中SBR 系統的N2O 排放情況如圖2所示。
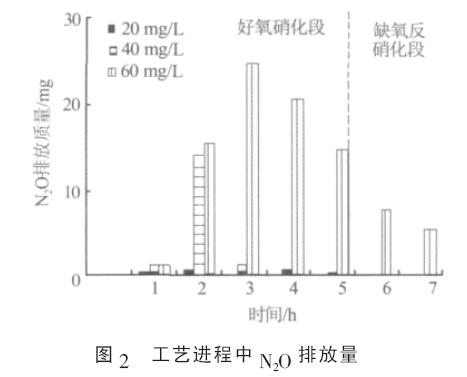
由圖2 可見,不同NH4+濃度下SBR 系統的N2O排放量有明顯差異。如在一個脫氮周期內,當NH4+質量濃度分別為20、40、60 mg/L 時,N2O 排放量分別為1.16、17.33、89.85 mg。
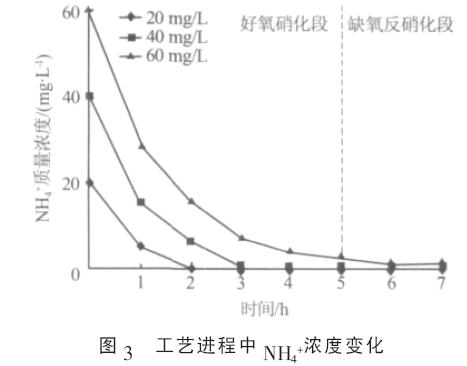
分析發現, SBR 系統中NH4+轉化速率與脫氮中N2O-N 所占的比例呈負相關。如當NH4+質量濃度為20 mg/L 時, 系統運行至第2 小時時NH4+全部轉化( 見圖3), 此時系統脫氮中N2O-N 所占比例為0.25%; 當NH4+質量濃度為40 mg/L 時, 系統中的NH4+到第3 小時時全部轉化, 和20 mg/L 時相比,NH4+轉化時期推遲1 h, 此時系統脫氮中N2O-N 所占比例為1.84%;而當NH4+質量濃度為60 mg/L 時,NH4+的轉化明顯受到抑制,此時SBR 系統N2O 排放迅速增加(見圖2),脫氮中N2O-N 所占比例上升至6.35%。實驗中,隨著NH4+濃度的提高,系統脫氮中N2O-N 所占比例最大相差25 倍之多。
2.2 N2O 排放時期實驗中, 在SBR 工藝的好氧硝化段, NH4+轉化的同時總氮也呈下降趨勢(見圖1、圖3),表明在好氧硝化段發生了同時硝化反硝化脫氮作用(SND)。在一個脫氮周期內,當SBR 系統硝化反硝化作用順利進行、系統有效脫氮時,系統N2O 排放時期主要在好氧硝化段的同時硝化反硝化階段(見圖2)。如本實驗中,當NH4+質量濃度為20、40 mg/L 時,系統同時硝化反硝化階段分別在0~2 h 和0~3 h(見圖1、圖3),在此階段系統排放的N2O 占總N2O 排放量的95%以上。而當系統氮素轉化明顯受到抑制時(見圖3),如當NH4+質量濃度為60 mg/L 時,不僅同時硝化反硝化過程中大量排放N2O, 而且缺氧反硝化段也有可觀的N2O 排放(見圖2)。
2.3 微生物群落特征
采用PCR-DGGE 技術, 分析了不同NH4+濃度下的微生物群落特征, 結果如圖4 所示。泳道1 和2、3 和4、5 和6 分別是NH4+質量濃度為20、40、60mg/L 時好氧硝化段和缺氧反硝化段的污泥樣。

由圖4 可知, 每個條帶代表一個可能的細菌類群或可操作分類單位(OTU), 條帶數越多說明生物多樣性越豐富, 條帶染色后的熒光強度則反映該細菌的豐富度。分析發現,不同NH4+濃度下條帶分布不盡相同, 如條帶a~d 是NH4+質量濃度為20、40mg/L 時所共有的條帶, 當NH4+質量濃度提高到60mg/L 時,這些條帶消失或明顯減弱;條帶e 和h 是NH4+質量濃度為60 mg/L 時特有的條帶;條帶f、g 和i 是不同NH4+濃度下所共有的條帶等。實驗結果表明,隨著NH4+濃度的提高,系統中微生物群落結構發生了相應變化。
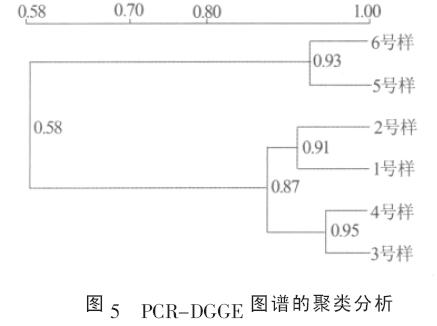
采用BIO-RAD QUANTITY ONE 4.0 軟件, 對PCR-DGGE 圖譜中微生物群落的相似性進行了UPGMA 聚類分析,見圖5。其中1 和2、3 和4、5 和6 號樣分別是NH4+質量濃度為20、40、60 mg/L 時好氧硝化段和缺氧反硝化段的污泥樣。相似性系數(Cs)為:
Cs=2j/(a+b)
式中:a、b———分別為DGGE 圖譜中相比較2 個泳道的條帶數目;
、j———共有的條帶數目。
Cs 越大,表示微生物群落的相似性就越高。結果發現:(1)在相同的NH4+濃度條件下,好氧硝化段和缺氧反硝化段微生物群落的相似性均在0.9 以上,表明在一個脫氮周期內的SBR 工藝的不同階段(好氧硝化和缺氧反硝化段),微生物群落較為穩定;(2) 從不同NH4+濃度下的微生物群落特征來看,NH4+質量濃度從20 mg/L 提高到40 mg/L 時,SBR 系統微生物群落的相似性為0.87,當NH4+質量濃度進一步提高到60 mg/L 時, 和前2 個NH4+濃度下(20、40 mg/L)的微生物群落相比,其相似性下降到0.58,表明NH4+質量濃度為20、40 mg/L 下的微生物群落相似性較高,但和NH4+質量濃度為60 mg/L 相比,微生物群落發生明顯差異。
實驗中,NH4+質量濃度從20 mg/L 提高到40mg/L 時,SBR 系統微生物群落較為穩定(Cs 為0.87),認為此時系統N2O 排放主要受到氮素轉化的影響;當NH4+質量濃度進一步提高到60 mg/L 時,系統微生物群落發生明顯變化(Cs 為0.58),認為此時污水脫氮中N2O 排放不僅受到氮素轉化的影響,同時還受到微生物群落變化的影響。可見,污水處理過程中,當環境條件發生劇烈變化時,微生物群落的變化對N2O 排放的影響值得重視。具體參見http://www.bnynw.com更多相關技術文檔。
3 結論
(1)隨著NH4+轉化效率的下降,SBR 系統脫氮中N2O-N 所占比例增加。實驗中,不同NH4+濃度下,脫氮中N2O-N 所占比例在0.25%~6.35%之間。
(2)SBR 系統中,當氮素轉化順利進行時,N2O排放時期主要局限在好氧硝化段的同時硝化反硝化階段,而當氮素轉化受到抑制時,好氧硝化段和缺氧反硝化段均有大量的N2O 排放。
(3)不同NH4+濃度下,SBR 系統微生物群落發生相應變化。相同的NH4+濃度下,SBR 系統好氧硝化段和缺氧反硝化段的微生物群落較為穩定。


