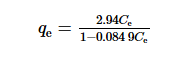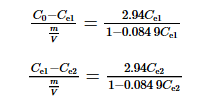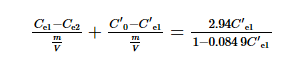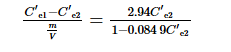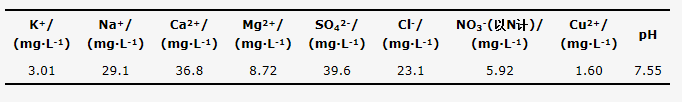人類的核能利用活動可能導致放射性廢物釋放到環境中,帶來巨大的安全隱患,其中最受關注的裂變產物之一是放射性碘。在碘的26種同位素中,125I、129I和131I會對環境產生較大的危害。日本福島核電站事故中,泄漏的放射性核素中含有大量129I和131I,并以氣態和液態形式通過大氣環流對多個國家和地區產生隱患。其中129I由于較長的半衰期對環境產生了更大的危害;而131I是核事故早期環境中放射性碘的主要成分,也嚴重污染生態環境。因此,研究高效的除碘方法具有重要的現實意義。
目前,國內外去除放射性I-的方法有化學沉淀、離子交換、膜分離和吸附法等。LIU等采用化學沉淀法,通過投加CuCl生成難溶化合物CuI來去除模擬廢水中的I-,對I-的去除率達到95.8%。楊云等在此基礎上,結合化學沉淀和膜分離工藝,使I-去除率達到95.0%。但是由于該工藝較復雜,工藝條件需保持低氧環境,投加藥劑量大,在出水中引入較多鹽類。離子交換法選擇性強,但是交換容量小,受共存離子的影響較大。吸附法作為傳統的處理方法,將一種或多種元素吸附在吸附劑表面或孔道,具有工藝簡單、清潔、無污染等優點。ZHANG等利用椰殼活性炭制備的改性活性炭,通過表面負載的納米Cu2O/Cu和活性炭的協同作用,對蒸餾水中的I-表現出較高的吸附特性,I-的去除率可以達到95.7%。但在自然水體中,共存離子可能對吸附效果產生負面影響。
傳統單級吸附工藝中吸附效率較低,多級逆流吸附工藝可更大限度地利用吸附劑的吸附容量,溶液中吸附質的濃度可以降到更低。水相流動方向與吸附劑相流動方向相反的吸附稱為逆流吸附。該工藝采用序批式操作,即原水首先與舊吸附劑接觸,充分利用其吸附能力;再投加吸附劑進一步降低水中污染物濃度。吸附完成后,所投加吸附劑成為舊吸附劑,可為下一次序批操作利用。ZHAO等采用粉末活性炭-微濾累積二級逆流吸附去除反滲透濃水中的有機物,在得到較高有機物去除率的同時,比單級吸附工藝節省42.8%的粉末活性炭投量;HAN等建立了二級逆流吸附-微濾工藝去除模擬放射廢水中的銫,與常規吸附相比,在相同的吸附劑投加量下,去除率由99.7%提高至99.9%。以上研究中,由于吸附劑都具有基本不脫附的特點,不會影響吸附劑的累積吸附效果,可以將其階段性排出反應器。
與ZHANG等研究相比,為進一步提高吸附劑在天然水體中的吸附效果,考慮到吸附劑脫附對累積吸附帶來的負面影響,開發改進型二級逆流吸附工藝,后文稱新型二級逆流吸附工藝。本文根據載帶機制和累積吸附原則,提出此工藝處理自來水中I-的計算方法,考察吸附劑在新型二級逆流吸附工藝中的除碘效果及其他水質參數,從而為工程應用提供參考。
1 材料與方法
1.1 材料
實驗原水模擬放射性碘污染的地表水,采用天津市津南區的自來水配置,水質參數見表 1。采用非放射性KI固體溶于當地自來水作為原水,原水中的I-濃度為2.00 mg·L-1。
表1 實驗原水水質
本實驗采用的吸附劑來自ZHANG等制備的具有高吸附性和穩定性的改性活性炭。將聚乙烯亞胺與Cu(NO3)2·3H2O溶解后與80~100目的椰殼活性炭于高壓釜內220 ℃下加熱3 h后,冷卻后洗凈、真空干燥后即得改性活性炭。
實驗所用試劑均為分析純,KI購于大連美侖生物技術有限公司,I-的濃度測定依據生活飲用水標準檢驗方法,使用TU-1810紫外分光光度計測定;pH由HACH-PHC101酸度計測定;水中陽離子由X7 Series電感耦合等離子體質譜儀測定;水中陰離子由DX-1100離子色譜儀測定;濁度由HACH-2100光電濁度儀測定,所用的恒溫搖床型號為HT-2102C,電動攪拌器的型號為D-8401WZ。
燒杯實驗所用微濾膜由上海密粒公司提供,其孔徑為0.22 μm。
1.2 方法
1.2.1 吸附動力學、不同吸附劑投加量和吸附等溫線實驗
取數個250 mL錐形瓶,各加入實驗原水和一定質量的吸附劑,置于恒溫搖床內振蕩,設定轉速為200 r·min-1、溫度為25 ℃。吸附一定時間后,用微濾膜進行固液分離,測定濾液中的I-濃度。其中吸附等溫線實驗原水I-濃度范圍為0.40~30.0 mg·L-1。
1.2.2 脫附實驗
與吸附實驗類似,向250 mL錐形瓶中加入200 mL實驗原水和一定量吸附劑,在恒溫搖床內達到吸附平衡,然后取出180 mL上清液并測定其中I-的濃度;向剩余含I-溶液中加入180 mL空白自來水,在恒溫搖床內脫附平衡后測定溶液中I-的濃度。用減差法計算解吸量后求得脫附率。
1.2.3 新型二級逆流吸附實驗裝置與運行
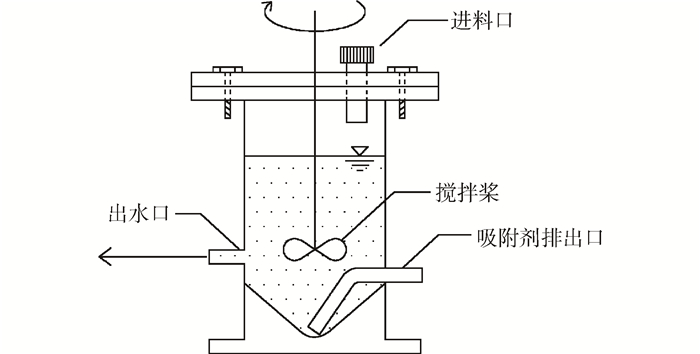
二級逆流吸附實驗在圖 1所示的反應器中進行。反應器的材料為有機玻璃,內徑60 mm,有效容積為200 mL,底部錐形角為90°。攪拌槳通過攪拌器控制轉速為200 r·min-1,反應器頂部設有進料口,左側為出水口,通過重力排水。右側為吸附劑排出口,其與蠕動泵連接,通過調整轉速,將沉淀在錐形底部的吸附劑通過硅膠管隨少量液體排出。
圖1 新型二級逆流吸附裝置圖
定義每次出水排出后滯留溶液體積與反應器中溶液總體積之比為稀釋因子F,本實驗中F值采用0.200。
新型二級逆流吸附的工作過程如下:
1) 啟動階段。向裝置中加入體積為V、濃度為C0的實驗原水和投量為m/V的吸附劑,攪拌至吸附平衡后,靜置沉淀5 min后用蠕動泵抽出吸附劑(排出吸附劑時帶出的溶液體積小于總溶液體積的3%)。再投入m/V的吸附劑,吸附平衡后,靜置沉淀5 min后在重力作用下排出體積為(1-F)V的上清液。
2) 運行階段。運行階段的每個周期原水經歷二級吸附,吸附級數按吸附過程的先后定義。一級吸附過程中向裝置中加入體積為(1-F)V的實驗原水,與裝置中剩余的溶液混合,混合液與裝置內的舊吸附劑吸附平衡后靜置沉淀5 min,并通過蠕動泵排出吸附劑;二級吸附過程中投加吸附劑,將m/V的吸附劑加入反應器中,吸附平衡后在重力作用下排出體積為(1-F)V的上清液,排出的上清液用微濾膜過濾后測定I-濃度。啟動階段運行之后,根據運行階段循環出水I-濃度驗證新型二級逆流吸附的計算方法。
2 結果與討論
2.1 吸附動力學
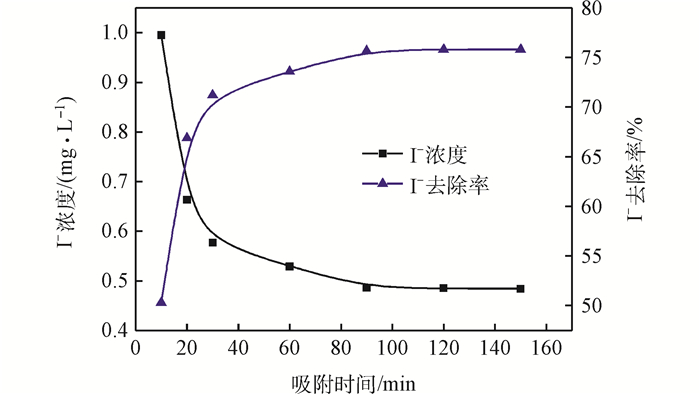
當吸附劑投加量為1.00 g·L-1時,動力學實驗結果如圖 2所示。在最初的30 min內, I-濃度迅速下降,在30~90 min之間I-濃度緩慢下降,90 min之后I-濃度基本不變,去除效率逐漸趨于恒定,故吸附平衡時間設定為90 min。此時I-的去除率達到76.0%左右。
圖2 出水I-濃度和去除率隨吸附時間的變化
2.2 吸附劑投加量對自來水中I-吸附效果的影響
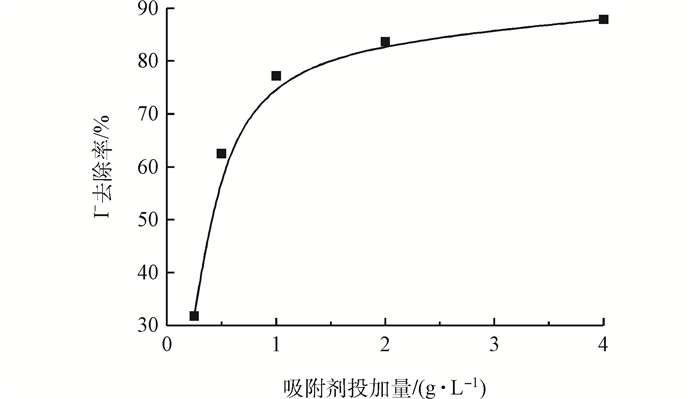
本實驗研究吸附劑投加量對去除I-的效果,優化投加量對于減少運行費用和固體廢物的產生具有重要意義。吸附劑投量與I-去除率的關系如圖 3所示。
圖3 吸附劑投加量對自來水中I-去除效果的影響
由圖 3可知,當投加量為0.25~1.00 g·L-1時,I-去除率迅速上升;投加量為1.00~4.00 g·L-1時,去除率上升變緩,最后趨于平衡。增加投量可使接觸面積增多,從而更有利于對I-的吸附,I-去除率逐漸增加。然而吸附過程是一個動態平衡過程,當吸附到一定程度,溶液中I-與吸附劑表面的I-達到動態平衡,增加投量,去除率無顯著提高而趨向平衡。根據圖 3的結果,吸附劑的投量確定為1.00 g·L-1,此時I-去除率為76.0%。由于自來水體中共存離子的干擾,使得吸附劑的吸附效果較ZHANG等在蒸餾水中獲得的去除率明顯降低,所以開發此新型二級逆流吸附工藝來提高去除率。另外,為與后續結果比較,研究投加量為1.25 g·L-1時I-的去除率,此值為78.0%。
2.3 吸附等溫線
用Langmuir吸附等溫式描述吸附劑對自來水中I-的吸附,當吸附劑投加量為1.00 g·L-1,吸附等溫式[17]如式(1)所示。式(1)取倒數后的擬合結果見圖 4。
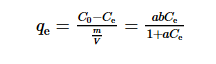
式中:qe為吸附劑相平衡濃度,mg·g-1;Ce為吸附平衡時的溶質濃度,mg·L-1;a,b為Langmuir等溫線方式常數,單位分別為L·mg-1和mg·g-1;m為吸附劑的投加質量,g;V為溶液的體積,L。
經擬合計算,以1/qe對1/Ce作圖可得到一條直線,該擬合直線的相關系數為0.993,由此可以推斷吸附過程較好地遵循Langmuir吸附等溫方程。式(2)為Langmuir吸附等溫線的表達式。
2.4 脫附實驗
按照1.2.2節中的方法進行實驗,吸附劑投加量為1.00 g·L-1。如果吸附劑吸附的I-沒有脫附,則加入空白自來水后,水中I-濃度的降低僅僅是稀釋作用,實驗結果如表 2所示。定義脫附率為脫附I-的質量與吸附I-的質量比。
表2 吸附和脫附平衡后液相及吸附劑相I-濃度
一般而言,吸附作用是可逆的。吸附平衡時,吸附質的液相濃度Ce和吸附劑相濃度qe可由式(2)計算,當平衡的吸附劑與低于Ce的溶液接觸時脫附可能發生]。由表 2可知,吸附和脫附后吸附劑相平衡濃度分別為1.53 mg·g-1和1.31 mg·g-1,所以計算得脫附率為14.3%,不可忽略。
由于吸附劑吸附I-后在水溶液中發生了較顯著的脫附,其在反應器內的累積會對I-的吸附產生負面影響。因此,在新型二級逆流吸附工藝中,在投加新吸附劑之前將反應器內的吸附劑排出,以去除吸附劑脫附產生的干擾。具體聯系污水寶或參見http://www.bnynw.com更多相關技術文檔。
2.5 新型二級逆流吸附的理論計算
新型二級逆流吸附工藝的計算基于以下假設:當I-的液相濃度高于與吸附劑吸附平衡的液相濃度時,此吸附劑仍具有吸附能力。二級吸附的平衡吸附量可疊加,且仍遵循式(2)。新型二級逆流吸附工藝流程如圖 5所示。反應器處理溶液的總體積為V (200 mL),吸附劑投量為m/V (1.00 g·L-1),原水I-濃度為C0 (2.00 mg·L-1),吸附后平衡濃度為Ce,吸附過程遵循吸附等溫式(2)。
圖5 新型二級逆流吸附工藝流程
啟動階段,先向反應器投入m/V (1.00 g·L-1)的吸附劑,吸附平衡后,液相溶質濃度達到Ce1;排出反應器內的舊吸附劑后,再投入量為m/V (1.00 g·L-1)的吸附劑,吸附平衡后,液相溶質濃度達到Ce2。由式(2)可得式(3)和式(4),分別計算Ce1和Ce2。
當F=0.200時,反應器的混合溶液剩余體積為0.200V,啟動階段投加的吸附劑也存在其中。在運行階段,向反應器中加入0.800V的實驗原水,假設吸附過程是在均勻混合后發生,則吸附前反應器內混合溶液濃度為C′0=0.200C0+0.800Ce2。吸附平衡后濃度為C′e1,根據假設及式(4),按式(5)計算C′e1。
其后排出反應器內的舊吸附劑,投入m/V (1.00 g·L-1)的吸附劑,吸附平衡后第1個循環出水I-濃度為C′e2,其計算如式(6)所示。
計算時公式中的吸附劑投加量m/V始終保持1.00 g·L-1,依次求解式(3)~式(6),可分別計算出Ce1、Ce2、C′e1和C′e2,結果見表 3。由表 3可知,工藝運行后理論出水濃度與啟動階段的濃度相同,C′e2為0.124 mg·L-1。
表3 各工藝段I-濃度計算值
在以后的各個周期中,由于二級逆流吸附的操作過程相同,所以每個周期出水I-濃度與第1周期的出水I-濃度C′e2相同,并維持恒定。由于實際實驗運行中,每個周期末出水體積為(1-F)V,運行中每個周期吸附劑的投加量為m,因此運行階段的實際吸附劑消耗量為m/(1-F)V。當F=0.200時,吸附劑用量為1.25 g·L-1。
2.6 計算方法的驗證
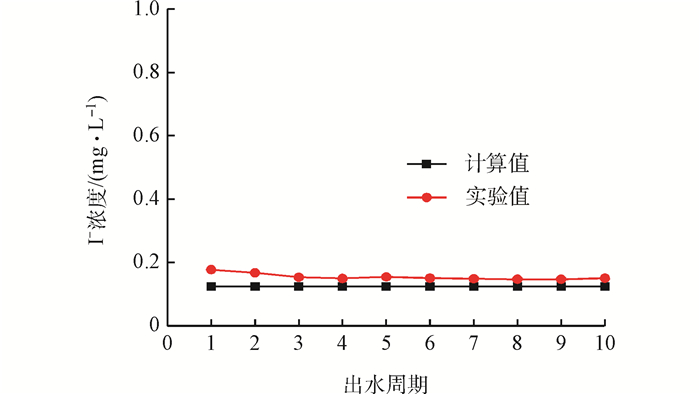
按照1.2.3節所述方法,獲得出水I-濃度實測值,結果如圖 6所示。將實測值與計算值進行比較,以驗證計算方法的合理性。由圖 6可知,實驗值與計算值較接近,具有較高的吻合度。因此,新型二級逆流吸附工藝的計算方法能較準確預測出水水質。
圖6 出水循環的實測值與計算值的對比
10個周期出水I-濃度實測平均值為0.150 mg·L-1,I-的去除率為92.5%;而計算值為0.124 mg·L-1,I-的計算去除率為93.8%,2個去除率差別不大。分析差別產生的原因:在攪拌過程中容器壁和攪拌槳會黏附少量吸附劑,致使實際參加吸附的吸附劑比實際投加的量要少,吸附效果受到影響。另外實驗期間由于部分舊吸附劑黏附在反應器內壁,未被完全排出而發生脫附也是產生誤差的原因。
與單級吸附相比較,新型二級逆流吸附工藝中吸附劑經過二級吸附,充分利用了其吸附容量。在相同的吸附劑投量下,I-去除率從78.0%提高至92.5%。
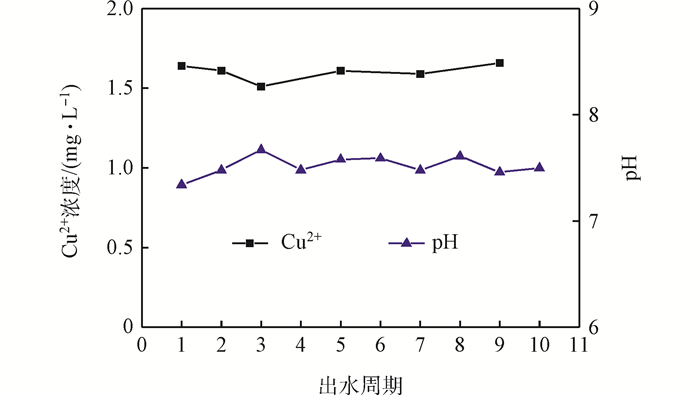
將10個循環的出水混合,測定混合出水的水質,結果如表 4所示。對比表 1和表 4可以看出,出水中NO3-(以N計)濃度較原水升高,可能是由于吸附劑制備過程中引入了Cu(NO3)2·3H2O,但仍符合中國生活飲用水衛生標準。另外,對出水中Cu2+和pH進行測定,結果如圖 7所示。出水中pH平均值為7.50,Cu2+平均濃度為1.60 mg·L-1,高于中國生活飲用水衛生標準,但是符合世界衛生組織頒布的《飲用水水質準則》,這方面有待進一步研究。
表4 新型二級逆流吸附循環出水水質
圖7 循環出水中的Cu2+及pH的變化
3 結論
1) 在以自來水配制的含I-溶液中,吸附劑對I-的吸附過程符合Langmuir吸附等溫式,吸附在90 min達到平衡。
2) 吸附劑在吸附I-后在水溶液中的脫附不可忽略,因此設計了新型二級逆流吸附工藝以消除脫附的影響,并推導出該工藝出水I-濃度的計算方法。
3) 在模擬的放射性含碘廢水中,新型二級逆流吸附工藝結合能夠更高效地去除水中的I-。實驗條件下運行,出水水質穩定,I-去除率可以達到92.5%,實驗值與計算值較接近,偏離程度較小。
4) 相比單級吸附,新型二級逆流吸附工藝中,吸附劑經過二次吸附,充分利用了其吸附容量。在相同的吸附劑投加量下I-去除率由78.0%提高至92.5%。與前期研究相比,該工藝較大幅度地提高I-去除率,降低了運行成本,對工程應用具有指導意義。(來源:環境工程學報 作者:李曉媛)