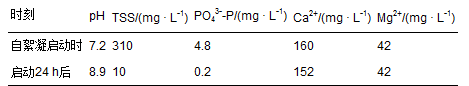利用微藻進行污水處理的歷史追溯已久. 早在20世紀50年代,Oswald等就提出利用微藻處理污水的設想. 此后,以藻-菌共生體系和高效藻類塘為代表的懸浮生長藻類塘系統在分散式污水處理中得到了廣泛的工程應用. 但這類系統因占地面積大、處理效果不穩定等局限性,一直未能成為污水處理的主流工藝. 近年來,在市政污水處理廠深度凈化需要以及渴望從污水中獲得生物柴油的驅動下,微藻污水處理在世界范圍內重獲新生.
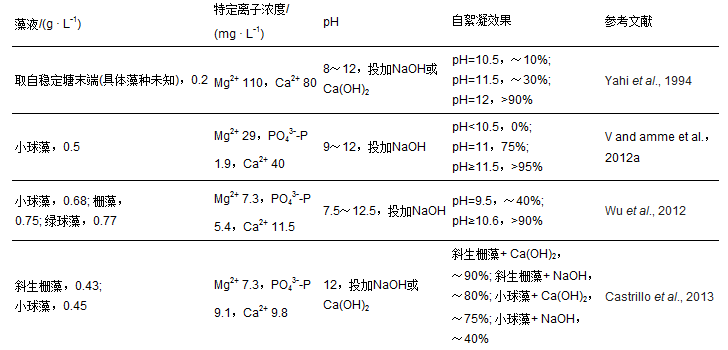
微藻生長過程需要大量吸收氮(N)、磷(P)等營養元素,可直接降低二/三級出水中N、P等污染物的含量. 通過固定二氧化碳(CO2)、產生氧氣(O2)、提高pH等間接作用,微藻還能創造出有效去除水中殘留有機物和病原性微生物的環境條件. 此外,微藻也具有吸附重金屬等有害物質的能力. 因此,微藻具有成為污水深度凈化技術的良好潛力. 在污水二/三級處理中,去除營養元素的常見藻種包括: ①綠藻門的小球藻(Chlorella)、葡萄藻(Botryococcus)、柵藻(Scenedesmus)和微綠球藻(Nannochloris)等,其中尤以小球藻(Chlorella)和柵藻(Scenedesmus)的研究報道為多;②藍藻門的節旋藻屬(Arthrospira sp.)、顫藻屬(Oscillatoria sp.)和席藻屬(Phormidium);③硅藻門的三角褐指藻(P. tricornutum)等.以上種屬的N、P去除效果可參見Cai等的綜述文章. 在藻種選擇的基礎上,微藻培養系統(反應器)的構建是實現微藻污水處理工程化應用的關鍵. 按微藻的生長方式不同,微藻培養系統可分為懸浮培養和附著培養兩大類. 懸浮培養系統可進一步分為開放式和封閉式兩類:①開放式系統主要指各類塘系統,典型的如高效藻類塘和跑道式藻類塘等;②封閉式系統主要指各類光生物反應器,分為管式(垂直、水平、螺旋)、圓柱式、薄板式和袋式等. 附著式系統包括光生物膜(平板)反應器和藻細胞固定化. 考慮到污水處理的實際情況(水量大,建造、運行成本等),開放培養系統仍將是微藻污水處理的主流反應器構型.
如上所述,藻細胞用于生產生物柴油是微藻污水處理重獲新生的主要驅動力之一. 通過微藻生產生物柴油具有其他任何產油作物無法比擬的優勢:①藻細胞的光合效率高,生長速度快、周期短,其產油量為47000~190000 L · hm-2 · a-1,是農作物的7~30倍;②生物質燃油熱值高,平均達33 MJ · kg-1,是木材或農作物秸稈的1.6倍;③不需占用農業用地;④生物質(藻細胞)生產和加工成本低,尤其是以污水為底物進行藻細胞培養時. 有鑒于此,美國、歐洲、澳大利亞、日本、臺灣等發達國家和地區都已將微藻培養作為實現污水生態處理和可再生能源生產的戰略發展目標. 常見的產油藻種及其油脂含量文獻已述及. 工業上以產油為目的的微藻培養一般采用封閉式光生物反應器,并且往往采用純培養或單株培養的方式. 當結合污水處理目標時,因巨大的水量及污水中復雜的成分(尤其是其中包含的混合種屬),以上培養方式將很難維持.
近年來,國內外學者在開發微藻污水深度凈化和可再生能源生產潛力方面進行了大量研究;在污水凈化機理、藻種篩選、反應器設計、工藝條件控制及藻細胞加工利用等方面都取得了積極的進展. 然而,無論從污水凈化本身,還是能源生產來說,藻細胞的分離、采收都一直是一個懸而未決的基礎性技術難題. 微藻細胞一般小于30 μm,帶負電荷,密度接近于水,這些特性使得藻細胞在水中往往處于穩定的懸浮狀態,很難像活性污泥那樣通過重力沉淀而實現自然分離. 結果,藻細胞會隨處理水大量流失,不僅二次污染處理水,而且導致反應器內生物量難以大量維持(一般僅為0.2~0.6 g · L-1). 低的培養密度導致去除效率低下,使得處理效果穩定性較差. 對此,往往需降低處理負荷,同時采用較長的水力停留時間(HRT),進而導致占地面積加大. 目前普遍應用的藻類塘系統HRT一般為2~6 d,當量人口占地一般>10 m2. 顯然,其占地面積要比二/三級污水處理主體單元還要龐大許多,這在用地緊張的城市中是很難被接受的.
從能源生產角度看,滿足工業利用要求的藻細胞原料其最佳生物量應達到300~400 g · L-1(干質量). 因此,常規培養下的藻液需濃縮1 000倍以上后方能在工業上加以利用. 這一高能耗的分離、濃縮過程是微藻能源生產中的主要能耗成本(占微藻生物質生產總成本的20%~50%. 過高的生產成本使得藻類生產生物柴油與化石燃料相比仍處于劣勢.
可見,藻細胞分離、采收困難是限制微藻技術大規模工業化應用的重要瓶頸. 微藻分離、采收常用的方法包括離心法、過濾法(包括膜濾)、氣浮法、直接重力沉降法和絮凝法等. 離心法是快速、可靠的分離采收方法. 但由于其極高的能耗和投資運行成本,在目前技術條件下并不具備大規模工程應用的潛力. 過濾法僅在分離絲狀藻時能耗和成本較低; 對于非絲狀藻極易形成膜污染,能耗和運行成本很高,不能滿足高效、低成本采收的要求. 氣浮法僅適用于采收單細胞藻類,在污水混合培養的條件下不能普遍適用; 此外,由于要產生大量的微小氣泡,其投資和運行成本/能耗亦很高,甚至可能高過離心法. 直接重力沉降法是成本最為低廉的分離、采收方法. 但其耗時長,分離效果和可靠性最差.
絮凝法是分離水中粗分散和膠體物質應用最為廣泛的方法,在20世紀80年代就已經用于微藻的分離采收(. 懸浮藻液經絮凝后能實現高效重力沉淀分離; 分離的藻細胞能直接被截留在反應器內,達到維持高生物量和保障出水水質的目的. 從單純的藻細胞采收角度來說,絮凝法是處理大量稀藻液時最為經濟、可行的方法. 雖然藻細胞經絮凝沉淀后還不能直接達到工業應用的要求,但已能顯著降低后續濃縮過程的能耗和成本. 因此,絮凝法已被視為實現微藻大規模分離采收的最佳方法. 根據是否需要添加絮凝劑可分為“外加絮凝劑法”和“自發性絮凝法”兩大類. 其中,外加絮凝劑法根據所使用的絮凝劑種類又可分為無機絮凝劑法、有機高分子絮凝劑法和生物絮凝劑法. 自發性絮凝按照發生機理可進一步分為高pH誘導的自發性絮凝和胞外聚合物(EPS)引起的自發性絮凝.
本文將從對微藻表面特性和絮凝機理的簡要介紹出發,系統總結各種絮凝分離方法的研究應用現狀,進而對各種方法進行綜合比較,以期最終明確微藻絮凝分離的發展方向.
2 微藻表面特性和絮凝機理 2.1 微藻懸浮液聚集穩定性的理論框架
擴展DLVO(XDLVO)理論是膠體化學中描述膠體穩定性的經典理論之一,已成功應用于描述活性污泥系統微生物細胞間的粘附聚集(絮凝)過程. 最近研究證實,該理論同樣適應于描述微藻懸浮液中藻細胞的聚集過程. 在XDLVO理論中,膠粒間的相互作用主要考慮了以下3種非共價鍵的相互作用力:①范德華力(Lifshitz-van der Waals interaction),它是色散力、極性力和誘導偶極力之和; ②靜電力(Electrostatic interaction),源自膠粒表面所帶電荷的靜電相互作用; ③Lewis酸-堿水合作用力(Lewis acid-base interaction),源自極性組分間的電子轉移. 膠粒間的總表面位能(GTOT(d))為以上作用力的位能之和:
式中,GLW(d)為范德華作用力位能,GEL(d)為靜電作用力位能,GAB(d)為Lewis酸-堿水合作用力位能.(d)表示作用力的大小和性質為膠粒間距的函數. 理論上,GTOT(d)>0則膠粒間相互排斥,處于聚集穩定狀態; GTOT(d)<0則膠粒相互聚集. 典型的總位能曲線一般包含兩個低位穴能(膠粒間距由遠及近分別為第二低位穴能Em2和第一低位穴能Em1),兩者之間存在一斥力能峰(Eb). 當膠粒相互靠近,到達第二低位穴能點(Em2)時,膠粒間處于一種可逆的粘附狀態;外界條件稍有變化則粘附的膠粒又將相互分離,是一種不牢固的粘結狀態. 只有膠粒的動能足夠大,足以克服斥力能峰到達第一低位穴能(EEm1)時才能形成牢固的粘結狀態,即發生絮凝)
2.2 藻細胞表面特性與聚集穩定性
決定總表面位能(式(1))的3種基本作用力中,范德華力一般表現為引力,其大小取決于膠粒間距、單位體積內的粒子數量和和粒子的極化率等. 而靜電力和Lewis酸-堿水合作用力的性質和大小則取決藻細胞的表面電勢和親/疏水性等表面特性.
2.2.1 表面電勢
藻細胞表面覆蓋著一層復雜的EPS,其主要成分為碳水化合物(EPSC)和蛋白質(EPSP),其他成分包括腐殖質(Humus-like Substances)、核酸(Nucleic Acids)、糖醛酸(Uronic Acids)等. 這些成分導致藻細胞表面富集了大量羧基(—COOH)和氨基(—NH2)等功能團. 這些功能團隨體系pH不同能接收或失去質子(H+),由此形成表面電荷及電勢. 例如: 當體系處于低pH條件時,羧基和氨基都將接收H+(質子化,protonation),形成正的表面電荷;相反,當體系處于高pH條件時,羧基將失去H+(去質子化,deprotonation),形成負的表面電荷;在特定pH條件下,可以形成羧基失H+而氨基得H+的情況,表面凈電荷為零,即等電點. 對于微藻,其等電點一般在pH=3. 而實際微藻培養系統的pH一般在7以上. 所以,藻細胞一般帶負電,即式(1)中的靜電作用力項表現為斥力.
膠粒表面電勢無法直接測量,只能測量出膠粒的Zeta電位后通過計算間接得出. Zeta電位是膠粒雙電層結構中滑動面與水溶液之間的電位差,是表征分散體系穩定性的重要指標. Zeta電位絕對值越高,膠粒之間的排斥力越大,體系越穩定. 實際培養條件下藻類的Zeta電位一般在-35~-15 mV之間. 因此,藻細胞間的靜電斥力一般較大,是藻細胞在水溶液中保持聚集穩定性的主要原因.
2.2.2 親/疏水性
藻細胞的表面親/疏水性決定了式(1)中Lewis酸-堿水合作用力的性質和大小,具體有如下規律: 疏水性藻細胞間的Lewis酸-堿水合作用力表現為引力; 親水性藻細胞間的Lewis酸-堿水合作用力表現為斥力; 親水和疏水藻細胞間的Lewis酸-堿水合作用力性質則取決于藻細胞的相對親/疏水程度,可為引力或斥力; 親/疏水程度越高,Lewis酸-堿水合作用力的值越大. 以上規律可通俗地理解為疏水細胞在水溶液中將受到水分子的“排斥”作用,因而細胞間有相互團聚(吸引)的趨勢; 而親水細胞則各自受到水分子的“吸引”,因而細胞間有分散在水溶液中的趨勢(相互排斥). 藻細胞間的靜電斥力一般大于范德華引力,因此在沒有外加絮凝劑消除靜電斥力的情況下,Lewis酸-堿水合作用力(表面親/疏性)的性質和大小對微藻懸浮液的聚集穩定性就具有決定性的影響,例如: 親水性藻細胞間的Lewis酸-堿水合作用力為斥力,因此該類藻細胞懸浮液總是能保持聚集穩定性; 只有Lewis酸-堿水合作用力為引力時(疏水藻細胞之間及特定親水-疏水藻細胞組合),微藻懸浮液才有可能發生絮凝. 細胞親/疏水性取決于其表面功能團: 表面富含長鏈烴類的微藻種屬(如,葡萄藻屬)表現為疏水性,因為長鏈烴類主要包含甲基和亞甲基等疏水基團,而羥基和羧基等親水基團只占很小一部分; 表面富含糖醛酸、中性糖和葡糖胺等成分的微藻種屬(如小球藻)則表現為親水性,因為這些成分能形成大量羥基、羧基和氨基等親水基團.
2.3 絮凝機理
根據上述XDLVO理論,微藻絮凝的基本原理就是要通過降低/消除靜電斥力(Zeta電位),使Lewis酸-堿水合作用力表現為引力等措施消除/降低藻細胞之間表面能的排斥能峰,使藻細胞能相互靠近到達第一低位穴能,從而緊密地粘結在一起形成絮體. 其中,外加無機絮凝劑的主要作用機理就是中和藻細胞表面的電負性,降低/消除靜電斥力. 外加高分子有機絮凝劑則主要通過吸附架橋原理起作用: 鏈狀高分子物質(少數情況也可能是無機絮凝劑形成的大膠粒)在靜電引力、范德華力和氫鍵力的作用下,一端吸附了某一膠粒后,另一端又吸附了另一膠粒,從而把不同的膠粒連接起來而形成絮體(圖 1). 生物絮凝劑和EPS誘導的自絮凝則可能是通過Lewis酸-堿水合作用力中的疏水引力及吸附架橋原理的綜合作用實現絮凝. 最后,投加絮凝劑形成的沉淀物和絮體等還可通過網捕和卷掃等物理作用進一步促進藻細胞的絮凝沉降.
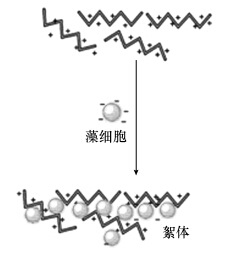
圖 1 吸附架橋作用示意圖
3 外加絮凝劑法 3.1 無機絮凝劑 3.1.1 無機絮凝劑的種類和作用機理
以鐵鹽和鋁鹽為代表的多價金屬鹽類和聚合金屬鹽類是傳統水處理中應用最為廣泛的絮凝劑,也是微藻絮凝中應用最早的外加絮凝劑. 典型絮凝劑包括:硫酸鋁,硫酸亞鐵,氯化鐵,聚合氯化鋁,聚合硫酸鋁,聚合硫酸鋁鐵,聚合氯化鋁鐵,聚合硫酸氯化鋁鐵等.
金屬鹽類絮凝劑主要是通過電性中和作用破壞藻細胞的聚集穩定性. Al3+、Fe3+等游離陽離子及其各種帶正電荷的水解產物能中和藻細胞表面所帶的負電荷,從而促進藻細胞碰撞聚集形成絮體,發生絮凝沉淀.此外,Al3+,Fe3+等金屬鹽還能形成[Al(OH)3]n、[Fe(OH)3]n等聚合體,以吸附架橋形式作用于藻細胞. 在特定pH下,這些金屬鹽類還可形成大量Al(OH)3及Fe(OH)3等沉淀物,以網捕卷掃作用促進微藻的絮凝沉降. 聚合金屬鹽類絮凝微藻的主要機理則是吸附架橋作用,同時也有電性中和及網捕卷掃作用.
3.1.2 無機絮凝劑的絮凝效果和影響因素
表 1總結了幾種典型無機絮凝劑在微藻分離采收中的絮凝條件及效果. 由于各研究采用了不同的計量基準(如,生物量以細胞個數 · mL-1或mg · L-1計)及不同的藻種和絮凝條件,無法直接進行橫向比較,但仍可以總結出一些要點:①鋁鹽、鐵鹽等多價金屬絮凝劑在合適的條件下都可有效絮凝(>80%)常見的微藻種屬;對于典型的稀藻液(濃度~0.5 g · L-1),藥劑投加量一般要達幾百mg · L-1藻液. ② 鋁鹽比鐵鹽的絮凝效率更高;金屬氯化物比金屬硫酸鹽的絮凝效率更高;這反映在達到類似絮凝效果,鋁鹽和金屬氯化物的投加量更小且所需絮凝時間更短. ③聚合金屬鹽類比非聚合金屬鹽類的混凝效率高,且在更廣的pH值范圍內有效.
| 絮凝劑 | 藻液 | 絮凝條件 | 絮凝效果:去除率(投加量),絮凝時間 | 參考文獻 |
| 單位:1. 單位為mmol · L -1 (以Al或Fe計); 2. 單位為g · L -1 . | ||||
| 硫酸鋁 硫酸鐵 聚合氯化鋁 聚合硫酸鐵 |
項圈藻( Anabaena ), 藻液濃度2×10 6 cells · mL -1 |
2 min快速攪拌(300 r · min -1 ), 25 min慢速攪拌(35 r · min -1 ), 2 h 沉淀,pH 7.5; 投加量 1 :硫酸鋁(0.175,0.25,0.375),硫酸鐵(0.175,0.21,0.25),聚合氯化鋁(0.175,0.26,0.375),聚合硫酸鋁(0.175,0.21,0.25) |
硫酸鋁: 74%(0.175),94%(0.25),95%(0.375); 硫酸鐵: 70%(0.175),75%(0.21),76%(0.25); 聚合氯化鋁: 67%(0.175),69%(0.26),73%(0.375); 聚合硫酸鐵: 94%(0.175),95%(0.21),96%(0.25) |
Jiang et al., 1993 |
| 硫酸鋁 硫酸鐵 氯化鋁 氯化鐵 |
微小小球藻( Chlorella minutissima ),藻液濃度220×10 6 cells · mL -1 |
投藥量 2 :0.25,0.50,0.75,1 | 硫酸鋁:80%(0.75),2 h; 硫酸鐵:80%(0.75),4 h; 氯化鋁:80%(0.5),1 h; 氯化鐵:80%(0.5),3 h; |
Papazi et al., 2010 |
| 硫酸鋁 硫酸鐵 三氯化鐵 氫氧化鈣 |
小球藻( Chlorella ), 藻液濃度0.53 g · L -1 |
投加量 2 :硫酸鋁(0.8),硫酸鐵(0.5), 三氯化鐵(0.3),氫氧化鈣(0.8) |
硫酸鋁:89.7%(0.8),90 min; 硫酸鐵:89.6%(0.5),90 min; 三氯化鐵:92.3%(0.3),30 min; 氫氧化鈣:91.7%(0.8),90 min |
薛蓉等, 2012 |
| 硫酸鋁 氯化鐵 氫氧化鈣 |
柵藻( Scenedesmus sp.), 藻液濃度0.54 g · L -1 |
1 min快速攪拌(800 r · min -1 ),1 min慢速攪拌(250 r · min -1 ),沉淀時間(2,5,10,30,60,120 min);投加量 2 :硫酸鋁(0.02,0.03,0.05,0.1,0.3),氯化鐵(0.06,0.08,0.1,0.15,0.2),氫氧化鈣(0.2,0.3,0.4,0.5,0.6) | 硫酸鋁: >95%(0.3),10 min; 75%(0.1),30 min; ~60%(0.02,0.03,0.05),120 min 氯化鐵: >95%(0.15,2),2 min; ~70%(0.06,0.08,0.1),120 min 氫氧化鈣: 90%(0.3,0.4),120 min; ~80%(0.5),120 min; ~60%(0.6),120 min | |
表 1 無機絮凝劑在微藻分離采收中的絮凝條件與效果
影響無機絮凝劑絮凝效率的因素主要有:絮凝劑的種類、pH、藻液濃度和投加量等. 絮凝劑種類對絮凝效果的影響在上文已有所論述. 一般而言絮凝劑所帶的電荷密度越高,絮凝效果越好;這正是鋁鹽、鐵鹽的絮凝效果要遠遠好于鈣、鎂和銨離子的原因所在. 此外,絮凝劑的水溶性也對其絮凝效果有顯著影響,如:氯離子的水溶性好于硫酸根,所以金屬氯化物的絮凝效果要好于金屬硫酸鹽.水溶性效應還可以解釋摩爾質量對絮凝效果的影響,如:盡管Fe3+和Al3+ 一樣帶正3價電荷,但鐵離子的摩爾質量大于鋁離子;摩爾質量越大,水溶性越差;所以鐵鹽的絮凝效率要低于鋁鹽. 鋁鹽的絮凝效果對pH高度敏感,最佳pH為4~5,這是因為在此pH條件下鋁的水解產物以帶正電的多核羥基配合物形式存在且最穩定;中性條件下,鋁的水解產物以Al(OH)3沉淀為主;pH>8.5時,水解產物將以帶負電的[Al(OH)4]-為主,無法形成有效絮凝. 一定范圍內絮凝效果與絮凝劑的投加量成正比; 但過量投加會使膠粒吸附過多的反離子,重新帶電而再次穩定; 因此絮凝劑使用存在一個最佳投加量,這是絮凝分離中早已得到深入分析的典型現象. 但最佳投加量隨藻液濃度的變化規律文獻中還存在不統一之處:一般而言所需絮凝劑的投加量隨藻液濃度的升高而線性增加,這符合電性中和的絮凝機理. 然而,Garzon-Sanabria等在使用氯化鋁絮凝微綠球藻時發現,當藻液濃度很高時,達到同樣絮凝效果的投加量卻數倍地低于稀藻液. Wyatt等在用氯化鐵絮凝小球藻時也得出了類似的結論. 其原因很可能是在高藻液濃度時形成了顯著的網捕和卷掃作用. 最后,最新研究表明微藻代謝產生的有機物對絮凝過程有顯著的抑制作用,其存在將成倍地增加絮凝劑投加量,這將顯著增加絮凝成本并對藻細胞的后續加工利用造成負面影響.
3.2 有機高分子絮凝劑法 3.2.1 種類與作用機理
有機高分子絮凝劑在微藻分離采收中亦很早便得到了應用. 目前商業化的有機高分絮凝劑主要為人工合成,以聚丙烯酰胺(Polyacrylamide)為代表. 近年來,天然高分子有機絮凝劑,如,殼聚糖(Chitosan)、陽離子淀粉(Cationic Starch)和纖維素等得到了越來越多的關注. 有機高分子絮凝劑的作用機理主要為吸附架橋作用. 因藻細胞帶負電的表面特性,高效的高分子絮凝劑必須為陽離子型的. 陰離子及非離子型的聚合高分子單獨使用時不能使微藻發生有效絮凝. 除架橋作用外,陽離子型高分子絮凝劑還可能局部逆轉藻細胞表面的電負性,使其某些部位帶負電而另一部位帶正電;從而使不同的藻細胞能直接通過靜電引力結合在一起,形成所謂的靜電互補聚集. 以下介紹幾種代表性的有機高分子絮凝劑.
a. 聚丙烯酰胺
聚丙烯酰胺分子量在400~2000萬之間,具有陽性基團(—CONH2). 該基團既是親水基團,又是吸附基團,所以能對微藻產生吸附電中和及架橋作用. 除橋連作用外,聚丙烯酰胺還有包絡作用. 發生橋連和包絡的高分子能形成三維網狀結構,通過卷掃網捕作用使微藻沉降分離.
b. 殼聚糖
殼聚糖是對甲殼素進行脫乙酰基而得到的,是少數陽離子型的天然高聚物. 其結構單元是2-氨基-2脫氧葡萄糖,通過β-1-4糖苷鍵連接起來(圖 2). 在酸性條件下,殼聚糖分子鏈上所帶的大量氨基以帶正電荷的胺離子形式存在,能中和藻細胞的電負性,同時借助高分子鏈的吸附架橋作用使藻體絮凝沉降. 當溶液呈現堿性時,殼聚糖表面所帶胺基非離子化或呈弱負電性,從而降低了其絮凝效率(李若慧等,2012).
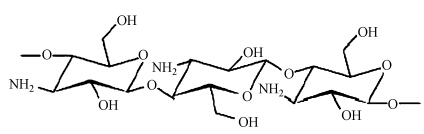
圖 2 殼聚糖結構
c. 陽離子淀粉
陽離子淀粉是在淀粉骨架中引入季銨基團,這樣就使得淀粉呈正電性. 又因淀粉分子固有的聚合結構,使陽離子淀粉具有電性中和及吸附架橋的雙重作用. 陽離子淀粉和殼聚糖一樣,也具有無毒、無污染、可生物降解的特點. 與殼聚糖比較而言,陽離子淀粉原料價格更低,更容易獲得. 最為顯著的是其季胺基團不受pH的影響,從而使其可在很寬的pH值范圍內適用.
3.2.2 絮凝效果與影響因素
表 2列出了幾種典型有機高分子絮凝劑在微藻分離采收中的絮凝條件與效果. 表 2顯示,聚丙烯酰胺雖然是水處理中應用最成熟的高分子絮凝劑,但其對微藻的絮凝效率卻并不理想; 在相對較高的投加量下(20~80 mg · L-1藻液)也僅能實現50%左右的絮凝效果. 這可能是因為其電荷密度較低所致. 因此對聚丙烯酰胺進行改性是一個重要的研究方向,即,通過在聚丙烯酰胺上引入胺類分子,生成季胺型陽離子以進一步提高絮凝效率和適用范圍. 此外,Chen等認為聚丙烯酰胺的高分子鏈展開程度不足是導致其絮凝效果不佳的原因.因此,從結構上對聚丙烯酰胺進行改進,增強高分子鏈的展開程度也是強化其絮凝效果的方向之一.
| 絮凝劑 | 藻液 | 絮凝條件 | 絮凝效果 | 參考文獻 |
| 聚丙烯酰胺 | 柵藻( Scenedesmus sp.),藻液濃度0.54 g · L -1 |
投加量: 20~80 mg · L -1 ; 絮凝時間120 min |
各投加量的絮凝效果基本一致,約50% | Chen et al., 2013 |
| 殼聚糖 | 微囊藻( Microcystis ),藻液濃度5×10 5 ~2×10 6 cells · mL -1 | 投加量: 0.1~1 mg · L -1 ; pH 4~9; 1 min快速攪拌(300 r · min -1 ),10 min中速攪拌(100 r · min -1 ),10 min慢速攪拌(50 r · min -1 ),沉淀30 min | 投加量>0.5 mg · L -1 時絮凝效果>90%; 適宜pH 5~7,最佳為6,大于8時基本無絮凝效果 | 翟玥等, 2009 |
| 殼聚糖 | 小球藻( Chlorella sp.),藻液濃度5×10 9 cells · mL -1 |
投加量: 5~100 mg · L -1 ; 攪拌60 min(100 r · min -1 ),沉淀60 min | 低投加量時絮凝效果隨投加量線性上升,最佳投加量為10 mg · L -1 (99%去除),繼續加大投加量絮凝效果下降 | Ahmad et al., 2011 |
| 陽離子淀粉 (Greenfloc 120) |
擬小球藻屬 ( ParaChlorella ), 斜生柵藻( Scenedesmus obliquus ); 藻液濃度0.075~ 0.3 g · L -1 |
投加量: 5~60 mg · L -1 ; pH 5~10; 5 min快速攪拌(1000 r · min -1 ), 25 min中速攪拌(250 r · min -1 ), 沉淀30 min |
擬小球藻屬:絮凝效果達80%以上的藥劑投加量與生物量之比約為0.1(藻液濃度0.3 g · L -1 對應投加量30 mg · L -1 ); 過量投加造成明顯的膠體保護作用; 絮凝效果基本不受pH影響. 斜生柵藻:絮凝效果達80%以上的藥劑投加量與生物量之比為0.03(藻液濃度0.3 g · L -1 對應投加量9 mg · L -1 ) | V and amme et al .,2010 |
| 陽離子淀粉 (玉米淀粉) |
斜生柵藻( Scenedesmus obliquus ),藻液濃度0.2~0.25 g · L -1 | 投加量/微藻生物量:0~0.18; pH 7; 2 min快速攪拌(200 r · min -1 ),10 min慢速攪拌(25 r · min -1 ),沉淀1 h | 在投加量/微藻生物量之比為0.0053時就達到了90%的絮凝效果(藻液濃度0.25 g · L -1 對應投加量1.3 mg · L -1 ) | Anthony et al .,2013 |
表 2 有機高分子絮凝劑在微藻分離采收中的絮凝條件及效果
殼聚糖和陽離子淀粉對淡水藻類都有非常高的絮凝效率: 一般在10~30 mg · L-1藻液的投加量下就可以達到80%以上的絮凝效果; 對于個別藻種甚至在1 mg · L-1左右的投加量下就能達到90%以上的絮凝效果. 這比達到同樣絮凝效果的無機絮凝劑投加量(表 1)要低一個數量級以上. 其原因主要是高分子絮凝劑具有顯著的吸附架橋作用,因此可以在藻細胞負電性遠未被中和的情況下(Zeta電位<<0)就實現高效絮凝.
影響高分子絮凝劑絮凝效果的主要因素有:摩爾質量、電荷密度、投加量、藻細胞濃度、離子強度/鹽度、pH和攪拌強度等. 摩爾質量較高的高分子絮凝劑具有更多的吸附架橋結合點,因此一般具有更好的絮凝效果. 電荷密度高的高分子絮凝劑具有更強的電性中和能力; 此外,高的電荷密度還有助于高分子鏈的充分展開,增強架橋能力. 投加量不足,絮凝效果不充分; 但投加過量,又會對膠粒起到穩定保護作用; 這與無機絮凝劑中最佳投加量的概念一致. 高的藻細胞濃度使顆粒間的碰撞更加頻繁,在一定范圍內將促進絮凝作用. 與無機絮凝劑相比,陽離子型高聚物的一個特點是,高的離子強度/鹽度對其絮凝效果有顯著的抑制作用.這是因為在高離子強度/鹽度情況下,陽離子型高聚物有團聚在一起的趨勢,架橋作用將顯著減弱 這使其在采收海洋微藻時受到限制. 殼聚糖一般在酸性條件下絮凝效果才顯著,這往往超出了微藻培養體系的正常pH范圍,從而限制了其應用. 而陽離子淀粉基本不受pH影響,在pH 5~10的范圍內都能維持+15 mV左右的Zeta電位,具有普遍的適用性. 低速攪拌對形成大的絮體有利; 過強的攪拌將破壞已形成的絮體.
3.3 生物絮凝劑法
生物絮凝劑(Bioflocculant)是近幾年微藻絮凝的研究熱點之一. 生物絮凝劑一般是指微生物代謝活動中產生的具有絮凝效果的胞外聚合物(EPS). 細菌、真菌和放線菌都是能產生生物絮凝劑的常見微生物(Lam and Lee, 2012). 生物絮凝劑在微藻采收中的具體應用方式主要包括以下幾種:①投加絮凝微生物的混合培養液(微生物細胞+培養液);②菌-藻混合培養(需在微藻培養系統添加有機碳源);③絮凝微生物的胞外抽取液(離心后的上清液)作為絮凝劑;④分離純化后的胞外提取物作為絮凝劑;⑤直接投加絮凝微生物細胞作為絮凝劑.
表 3總結了各種生物絮凝劑在微藻絮凝分離中的應用情況. 表 3顯示,生物絮凝劑的絮凝效率亦很高,一般在投加量為10~30 mg · L-1藻液時便可達到>80%的絮凝效果,作用明顯好于無機絮凝劑(表 1). 但在絮凝效果的影響因素上卻存在不少相互矛盾之處. 一些研究顯示絮凝效果會隨pH升高明顯加強,但也有研究顯示絮凝效果基本不受pH影響;多數研究表明,多價陽離子能顯著促進絮凝甚至是形成絮凝的必要條件,但在少數研究中多價陽離子對絮凝效果基本沒影響;Lee等顯示絮凝微生物利用不同碳源產生的絮凝劑絮凝效果基本一致,而Wang等以不同碳源為底物產生的生物絮凝劑絮凝效果迥異.這些矛盾可能是各種生物絮凝劑在種類、組成及絮凝機理上的不同而導致的.
| 來源 | 應用方式 | 藻液 | 絮凝條件 | 絮凝效果及影響因素 | 參考文獻 |
| 芽孢桿菌 ( Paenibacillus sp.) |
直接投加培養液(原液) | 小球藻( Chlorella vulgaris ),藻液濃度0.062 g · L -1 | 投加量20 mL · L -1 ,陽離子6.8 mmol · L -1 (CaCl 2 ,MgCl 2 ,FeCl 3 ,CaCl 2 ,KCl,NaCl); pH 5~11 | 77%~86%; 絮凝效果隨pH升高而增強; 多價陽離子的助凝效果顯著好于單價陽離子,CaCl 2 最佳 | Oh et al ., 2001 |
| 施氏假單胞菌 ( Pseudomonas stutzeri ) 和蠟樣芽孢桿菌 ( Bacillus cereus ) |
菌-藻混合培養 | 顆石藻( Pleurochrysis carterae ),藻液濃度 ~0.5 g · L -1 |
0.1 mL菌液 + 100 mL藻液; 外加碳源: 乙酸,葡萄糖,甘油(0.1 g · L -1 ); 絮凝(共同培養)時間: 6,24 h | 6 h: 45%~53%; 24 h: 88%~94%; 外加碳源種類對絮凝效果沒顯著影響 | Lee et al ., 2009 |
| 多粘類芽孢桿菌 ( Paenibacillus polymyxa ) |
投加抽取液(原培養液稀釋10倍并離心后的上清液) | 柵藻( Scenedesmus sp.),藻液濃度2.35 g · L -1 | 投加量1%( V/V )+ 陽離子(單獨或組合):CaCl 2 ,MgSO 4 ,FeCl 3 ,Al 2 (SO 4 ) 3 | 陽離子單獨投加: 0.5 mmol · L -1 FeCl 3 (35%)>10 mmol · L -1 CaCl 2 (18%); 陽離子組合投加>65%,最佳95%(10 mmol · L -1 CaCl 2 + 0.26 mmol · L -1 FeCl 3 ) | Kim et al ., 2011 |
| 枯草芽孢桿菌 ( Bacillus subtilis ) |
投加分離純化后的胞外提取物(γ-聚谷氨酸) | 原始小球藻( Chlorella protothecoides ),藻液濃度1.2 g · L -1 | 投加量10~30 mg · L -1 ; pH 6.5~8.5 | 投加量10~20 mg · L -1 :絮凝效果隨投加量增加而增強,20 mg · L -1 時達90%;繼續增大投加量絮凝效果下降;pH無顯著影響 | Zheng et al ., 2012 |
| 芽孢桿菌( Bacillus sp.) | 投加微生物細胞(100倍濃縮) | 微擬球藻( Nannochloropsis sp.),藻液濃度1×10 7 cells · mL -1 |
微生物細胞/藻細胞: 1/125~25/1;pH 6~10;二價陽離子(Ca 2+ /Mg 2+ )0.125~16 mmol · L -1 | 微生物細胞/藻細胞:<1時絮凝效果隨投加量增大而增強,=1時最大達73%,繼續增大投加量絮凝效果下降;pH<9時解絮;二價陽離子的存在具有關鍵作用,以Ca 2+ 更為顯著 | Powell et al ., 2013 |
| Solibacillus silvestris (培養于不同碳源) | 投加抽取液(6000 r · min -1 離心后的上清液) | 微擬球藻( Nannochloropsis oceanica ),藻液濃度未知 | 絮凝劑量/藻液量:3:1;pH 6.7~10.7;陽離子(KCl,CaCl 2 ,FeCl 3 )0.01~0.1 mmol · L -1 |
pH<8,絮凝效果<20%;pH>8,75.4%~88.2%;陽離子無影響;碳源種類有顯著影響 | Wan et al ., 2013 |
表 3 各種生物絮凝劑在微藻分離采收中的應用
在絮凝機理上,絕大部分文獻中只考慮了靜電作用力,把生物絮凝歸結于吸附架橋作用,具體又可細分為以下兩種機制:①長鏈EPS在不同部位吸附多個帶負電的藻細胞形成架橋作用(Bridging); ②短鏈EPS在局部逆轉藻細胞的電負性,從而形成所謂的靜電互補效應(Patching)(圖 3).這一理論的基礎是將生物絮凝劑(EPS)默認為陽離子型高聚物. 但如2.2.1節所述,EPS在中性及堿性條件下本身是帶負電的. 那么,生物絮凝劑是如何實現陽離子化的呢?一個相對成熟的理論為二價陽離子架橋理論(Divalent Cation Bridging(DCB)Theory),可結合圖 4說明如下: EPS本身具有多個帶負電的活性部位,這使其能強烈吸附環境中的二價陽離子. 被吸附的二價陽離子所帶正電荷只被EPS中和了一半,所以能另外吸附一個帶負電的藻細胞. 由此,多個藻細胞通過二價陽離子的架橋作用連接在EPS上,形成大的絮體. 這一理論能很好地解釋為什么多價陽離子對生物絮凝具有顯著的強化作用甚至是絮凝形成的必要條件. 這一理論也能解釋絮凝效果隨pH升高而增強的現象: pH升高,EPS電負性增強,吸附二價陽離子的能力增強,所以架橋作用增強. 但如上所述,在部分研究中陽離子的存在對絮凝效果根本就沒有影響(Wan et al., 2013). 這就無法用DCB理論解釋了. DCB理論最根本的缺陷在于,理論上應該是所有帶負電的EPS都能通過二價陽離子的架橋作用形成絮凝. 但這顯然是與事實不符的. 這一問題將在4.3節部分得到進一步討論.
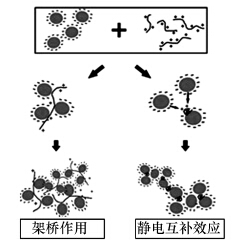
圖 3 生物絮凝劑的絮凝機理(Salim et al., 2011)
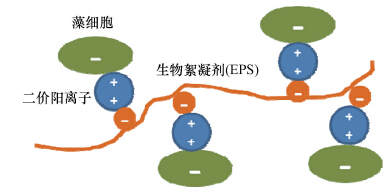
圖 4 二價陽離子架橋原理
4 微藻自發性絮凝 4.1 概述
微藻有時能在沒有添加任何絮凝劑的情況下發生絮凝,這一現象被稱為自發性絮凝(Auto-flocculation)首先描述了這一現象. 他們發現:藻類塘中的微藻在溫度較高且光線充足的時候能自然地形成絮體.此后,很多學者都證實了類似現象的存在并開展了相關研究. 目前形成的基本共識為,微藻自發性絮凝是由兩種不同機理引發的:
(1)在高pH下,鈣、鎂等離子形成帶正電的沉淀物,起到電性中和作用從而引發絮凝. 文獻中的自發性絮凝一般即指此類. 高pH可以是由微藻光合作用消耗水中無機碳(Inorganic Carbon,IC)自然形成,也可通過人工添加堿性物質(石灰,氫氧化鈉等)而形成. 嚴格來說,只有前者才符合自發性絮凝的定義. 但考慮到兩者的實質都是形成帶正電的沉淀物,本文在此將兩者一并納入高pH誘導的自發性絮凝范疇.
(2)部分藻種在其生理活動中能產生大量具有絮凝作用的胞外聚合物,起到生物絮凝劑的作用(參見3.3節部分)從而引發絮凝. 高效藻類塘中常見的集星藻屬(Actinastrum)、微芒藻屬(Micractinium)、柵藻屬(Scenedesmus)、空星藻屬(Coelastrum)、盤星藻屬(Pediastrum)及膠網藻屬(Dictyosphaerium)等常通過該機理形成大的群落結構(50~200 μm)而得以自然沉降. 文獻中常將其歸為生物絮凝一類(參見3.3節部分). 因為該情況下的生物絮凝劑為藻細胞自身所產生,本文在此也將其納入自發性絮凝并定義為EPS引起的自發性絮凝.
4.2 高pH誘導的自發性絮凝
如上所述,高pH誘導的自發性絮凝其實質為所生成的帶正電沉淀物的電性中和作用. 因此,誘導此類自發性絮凝的關鍵就是明確在微藻正常培養條件下所能形成的沉淀物種類和性質. 污水中一般含有大量的鈣、鎂、碳酸根和磷酸根等離子,在堿性條件下比較容易形成的沉淀物主要包括:磷酸鈣,氫氧化鎂和碳酸鈣. 大量研究證實,碳酸鈣本身帶負電,最多只能通過網捕和卷掃作用實現非常有限的絮凝效果. 磷酸鈣和氫氧化鎂帶正電,理論上都可誘導自發性絮凝. 但兩者形成的具體條件差別較大,以致文獻中的結論常常容易引起誤解. 為此,以下予以詳述.
Sukenik和Shelef(1984)首次定量、系統性地研究了高pH下的微藻自絮凝現象,結論性認為,磷酸鈣是誘導自絮凝的關鍵沉淀物.他們的試驗包括兩部分:①戶外培養系統的自絮凝試驗: 采用間歇培養,周期為8 d; 前7 d連續通入CO2使pH維持在7.0; 第8天停止CO2供應和攪拌,監測絮凝效果和相關水質參數(pH,TSS,PO43--P,Ca2+,Mg2+,堿度)的變化情況. ②室內絮凝試驗(Jar Test): 取處于對數增長期的二形柵藻和小球藻置于和戶外培養系統相同的培養基,調節pH為2.5~10.5進行絮凝試驗(80 r · min-1 1 min,30 r · min-1 15min,沉淀15 min),監測絮凝效果和相關水質參數變化. 戶外培養試驗結果表明,系統停止CO2供應和攪拌24 h后,體系pH迅速升至8.9,PO43--P、Ca2+同步降低,高效絮凝(96%)形成,而Mg2+維持不變(表 4). 由此初步證明,自發性絮凝是由高pH下的磷酸鈣沉淀誘導的. 室內絮凝試驗結果顯示:pH 5.0~7.5時無絮凝發生. pH>8.5后形成了高效絮凝(~98%),與戶外試驗結果一致. 進一步試驗顯示,在PO43--P為6.2 mg · L-1的情況下,Ca2+(2.0 mmol · L-1)在pH≥8.5時就能生成沉淀并引發絮凝;而Mg2+(2.0 mmol · L-1)要在pH≥10.5后才能生成沉淀進而引發絮凝. 如果沒有PO43--P存在,則Ca2+在整個堿性范圍內都不能引起絮凝.
表 4 自絮凝前后的水質參數變化
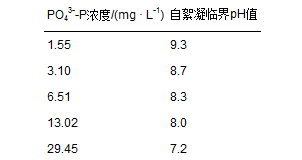
這些實驗結果充分證明,在微藻生長的正常pH范圍內(8~10),磷酸鈣是誘導自絮凝的關鍵沉淀物. 更具工程意義的是,Sukenik和Shelef(1984)發現自絮凝的臨界pH值(絮凝效果達50%的pH)將隨PO43-(表 5)和Ca2+(未顯示)濃度的上升而下降; 在含高濃度Ca2+和PO43- 的培養液中,微藻自絮凝甚至可以在中性條件下就發生. 這說明當以含磷較高的市政污水為底物時,可相對較容易地在微藻生長的正常pH值范圍內,通過生成磷酸鈣沉淀同步實現自發性絮凝和高效除磷.
表 5 小球藻在不同磷濃度下的自絮凝臨界pH值
然而,除少數學者繼續證實磷酸鈣在誘導微藻自絮凝中的核心作用外,大部分研究都顯示氫氧化鎂才是誘導自絮凝的關鍵沉淀物,代表性研究如下:
(1)Vandamme等(2012a)在研究小球藻自絮凝時發現,在pH≤10.5時均無自絮凝發生; 當pH調至11時,實現了75%的絮凝效果; pH≥11.5后絮凝效果顯著,達95%以上(表 6). 此時若加入EDTA(最終濃度0.5M)掩蔽Ca2+、Mg2+等二價離子,則絮凝效果急劇下降至<20%. 這初步證明了鈣/鎂沉淀在誘導自絮凝中的關鍵作用. 進一步研究表明,若溶液中只存在Ca2+(1~100 mg · L-1),在高pH下(10.5~12)確實也能形成沉淀物,但始終不能形成有效絮凝(<20%). 而當溶液中存在Mg2+(1.8 mg · L-1)時,在pH=10.5就可實現25%的絮凝效果; 在pH=12時絮凝效果顯著增至85%. 當Mg2+濃度≥3.6 mg · L-1后,pH=10.5就可達90%以上的絮凝效果(注:該實驗條件(藻細胞濃度等)與表 6不同,故臨界pH和絮凝效果有所差異).
表 6 以氫氧化鎂沉淀誘導的自發性絮凝
(2)Sirin等(2012)在研究三角褐指藻的自絮凝時發現,在pH=10.5時絮凝后溶液中的Mg2+下降了約16%,而Ca2+基本不變; 當pH增至11時,溶液中基本已沒有Mg2+殘留,而Ca2+僅降低了14%(Sirin et al., 2012). 這說明在pH=10.5~11時生成的沉淀物主要為鎂沉淀物.
(3)Smith和Davis(2012)發現,Mg2+、Ca2+和CO32-離子中,只有Mg2+(9.6 mmol · L-1)存在時才能在高pH下(>10)實現高效絮凝;而Mg2+缺乏時(Ca2+、CO32-均為9.6 mmol · L-1),即使Ca2+沉淀了75%也不能形成有效絮凝(Smith and Davis, 2012).
以上實驗結果似乎均已證明,高pH下只有Mg沉淀物才能有效誘導自絮凝. 然而,仔細考察這些研究中的特定離子濃度(表 6)就可發現,其Ca2+、PO43-離子中至少有一項或兩項的濃度均較低(與表 5對比),因此,在pH=8~10的范圍內不能形成大量磷酸鈣沉淀; 只能在更高pH下(>10.5)生成Mg(OH)2沉淀時才能誘導自絮凝. 綜合以上所有結果,可以得出如下結論: 磷酸鈣和氫氧化鎂沉淀都可有效誘導出自發性絮凝. PO43--P、Ca2+濃度均較高時,磷酸鈣沉淀在相對較弱的堿性條件下(pH 8~10)就可生成并誘導出顯著的自絮凝;PO43--P/Ca2+濃度較低時,則需進一步提升pH至10.5以上,產生氫氧化鎂沉淀后才能誘導出自絮凝.
4.3 胞外聚合物(EPS)引起的自發性絮凝
20多年以前,籍EPS形成自發性絮凝的藻種便在微藻分離采收中得到重視.Borowitzka和Borowitzka分離出了藍藻門的一株膠鞘藻. 它能分泌出大量具有絮凝作用的EPS,其主要成分包括多聚糖、脂肪酸和蛋白質.此后,自絮凝藻種如鮑氏席微藻及絲狀藻等在污水處理中都得到了應用. 但時至今日,對此類自絮凝的研究總體來說還十分有限.
在實際應用上,一般思路為將自絮凝藻種投入非自絮凝藻種培養系統以實現絮凝分離. Salim等(2011)研究了淡水自絮凝藻種鐮形纖維藻斜生柵藻對小球藻絮凝作用及海洋自絮凝藻種四鞭片藻對富油新綠藻的絮凝作用.實驗結果顯示,四鞭片藻的絮凝效果最佳,可達70%左右;斜生柵藻次之,絮凝效果可達30%左右;鐮形纖維藻絮凝效果最差,約20%. Guo等考察了自絮凝斜生柵藻藻株S. obliquus AS-6-1對非絮凝淡水藻株S. obliquus FSP-3、C. vulgaris CNW-11和海洋微藻N. oceanica DUT01的絮凝作用. S. obliquus AS-6-1對淡水藻株均取得了80%以上的良好絮凝效果;而對海洋微藻的絮凝效果則相對較差,低于60%.以上實驗結果表明,自絮凝藻株的絮凝效果會因目標藻種而異,這在實際應用中存在著很大的局限性.
目前對于微藻EPS誘導自絮凝的機理的研究更為有限,一般只是籠統地認為與生物絮凝劑的機理一致(參見3.3節部分). 在相互作用力上,絕大部分研究只考慮了基于DCB原理的靜電作用力,只有最近極少數研究考慮了Lewis酸-堿水合作用力. 如3.3節所述,單純地用DCB原理(圖 4)解釋藻細胞EPS的絮凝機理將存在很大的缺陷. 因為按此理論所有產生EPS的微藻種屬都應該能通過DCB原理發生自絮凝,而實際上只有某些特定藻種產生的EPS才有絮凝作用. 一個可能的解釋為:非絮凝藻種產生的EPS數量較少,架橋能力有限;而自絮凝藻種能產生大量EPS,所以絮凝效果顯著. 另一個可能的解釋為,非絮凝藻種和自絮凝藻種所產生的EPS在組成和性質上有所不同. 例如,Guo等(2013)發現,在EPS各組分中只有多聚糖為絮凝的活性成分.因此,如果不同藻種產生的EPS中多聚糖的含量不同,那其絮凝效果就可能有顯著差異. 但Guo等進一步發現:無論是投加Ca2+,還是用EDTA掩蔽Ca2+,對絮凝效果都沒有影響,這就從根本上與DCB理論相悖了.
Ozkan和Berberoglu則從藻細胞的親/疏水性表面特性出發,在靜電作用力的基礎上增加了對藻細胞間Lewis酸-堿水合作用力的考察. 他們的研究結果表明: Lewis酸-堿水合作用力在XDLVO的3種基本作用力中最強,在微藻的自絮凝中具有關鍵作用. 當微藻懸浮液中存在適量疏水性較強的微藻種屬(如,布朗葡萄藻)時,即使是電負性較大的親水-疏水混合藻液也能形成絮凝; 如果只考慮范德華力和靜電力,這一現象將無法得到解釋(GTOT(d)= GLW(d)+ GEL(d)> 0,理論上不發生絮凝); 而考慮Lewis酸-堿水合作用力后,理論預測與實際觀察得到了很好的吻合(GTOT(d)= GLW(d)+ GEL(d)+ GAB(d)< 0,理論預測為發生絮凝). 這些研究成果為理解EPS誘導自絮凝的機理和促進自絮凝效果提供了非常有前景的思路. 因此,后續無論對生物絮凝還是EPS誘導的自絮凝,都應在完整的XDLVO理論框架內考察范德華力、靜電力和Lewis酸-堿水合作用力的綜合作用. 對活性污泥EPS的研究發現: EPS中的蛋白質是形成疏水性的主因,而碳水化合物是形成親水性的主因; EPS的數量和組成受生長階段、底物水平等因素影響,對微生物絮凝有關鍵影響.而對藻細胞EPS各組分的產生、變化規律及其對表面特性影響的系統研究幾乎還是空白. 這方面的研究無疑將為理解和調控微藻自絮凝提供非常有價值的信息.
4.4 影響因素
自發性絮凝的發生機理決定了其影響因素. 對于高pH誘導的自發性絮凝,其根本因素為微藻光合作用提升pH所能到達的程度和所能形成帶正電沉淀物的特定離子濃度. 對于EPS引起的自發性絮凝,其影響因素則更加復雜,理論上包括所有影響EPS產生和組成的因素.
4.4.1 光照
光照是微藻生長繁殖的基本要素,對高pH和EPS誘導的自發性絮凝都具有重要影響. 首先,光照直接決定了微藻光合作用的程度. 光照越強,光合作用越充分,水中無機碳消耗越徹底,pH上升越高,越有利于高pH誘導的自絮凝發生. 其次,光照也是影響EPS產生的關鍵因子. Moreno等發現光照強度由345 μmol · m-2 · s-1增加到460 μmol · m-2 · s-1后,魚腥藻的EPS含量增加了4倍. Rebolloso-Fuentes等也發現,在較高的外部光照條件下,紫球藻EPS的含量顯著增加. 因此,充分的光照是誘導自發性絮凝的有利因素.
4.4.2 特定離子
Ca2+、Mg2+和PO43-等特定離子的濃度決定了沉淀物的種類和產生的臨界pH值,對高pH誘導的自發性絮凝具有決定性影響. 從發生機理來看:PO43--P/Ca2+離子都大量存在時,在較弱的堿性條件下(pH 8~10)磷酸鈣沉淀就可大量生成并成為自絮凝主導因素;PO43--P/Ca2+的其中之一濃度較低時,則需進一步提升pH至10.5以上,產生氫氧化鎂沉淀后才能誘導出自絮凝(參見4.2節部分). 從絮凝效果來看:以上離子濃度越高,生成帶正電的沉淀物越多,電性中和能力越強,絮凝就越充分. 因此,將上述特定離子維持在較高水平對實現高pH誘導的自發性絮凝至關重要.
4.4.3 溫度和生長階段
溫度對微藻EPS形成具有重要影響.高溫刺激EPS的形成,而低溫下由于細胞新陳代謝降低EPS的形成受到抑制. 但EPS產生的最佳溫度因藻種不同而異,如:布朗葡萄藻(Botryococcus braunii)在溫度低于23 ℃幾乎不分泌EPS,其最佳溫度為30~33 ℃而魚腥藻(Anabaena sp.)在30~35 ℃范圍內EPS產量都很少,只有在40 ℃以上EPS才大量產生. 微藻所處生長階段對藻細胞密度、表面性質和EPS的產量及成分等都有顯著影響.Lavoie和de la Noüe發現,老齡化的(Aging)的藻細胞密度增大,易于沉淀.Zhang等發現,小球藻從對數增長期進入穩定期后,其表面電負性減弱,易于發生絮凝Lavoie和de la NoüeZhang等和Salim等都發現微藻在對數期EPS產量很少,而在穩定期或衰減期產量則顯著增加. Salim等還進一步證實EPS的組成將隨生長周期的不同而變化(Salim et al., 2013). 因此,與活性污泥類似,微藻處于穩定期或衰減期時自絮凝效果較好.在實際培養中可將微藻的生長階段控制在穩定期或衰減期以促進自發性絮凝的形成.
4.4.4 底物水平
N、P等營養元素的缺乏將刺激微藻EPS的生產,這與細菌、真菌等微生物一致. 基于此,在運行中可采用高密度培養以獲得較低的F/M值,以自然形成底物受限的工藝條件. 而微藻生長的另一重要底物——無機碳(IC)受限則將抑制EPS的生產. 如,Cordoba-Castro等發現斜生柵藻(Scenedesmus obliquus)的EPS生產隨CO2的供給而增加:在高CO2供給條件下(4%),微藻的生長和EPS產量都最大;而CO2供給下降后EPS的生產也隨之降低.從強化EPS生產的角度來看,在實際運行中無疑應加強IC的供給. 然而,如Pragya等所指出,為強化基于高pH的自絮凝則應限制IC供給,以達到盡可能高的pH條件.因此,對IC的調控應權衡其對高pH和EPS兩種自絮凝正反兩方面的綜合效應.
4.4.5 微藻種屬
無論是基于高pH的自絮凝還是基于EPS的自絮凝,其絮凝條件和效果都將隨目標藻種不同而異(參見4.2節和4.3節部分). 這可能是由于藻細胞在表面特性和生理特性上的不同而導致的. 如,電負性較高的藻細胞需要更多帶正電的沉淀物生成. 又如多細胞和大型絲狀藻種比單細胞藻種更容易絮凝沉降. 在這方面需要綜合考慮微藻種屬的污水凈化能力、藻細胞的利用價值等,選擇性富集易于絮凝沉降的藻種.
4.4.6 溶解性有機物
與外加混凝劑類似(參見3.1.2部分),水中溶解性有機物(DOM)對自絮凝也會產生顯著的抑制作用. 這些DOM既可能是原水中帶來的腐殖質,也可能是藻類代謝產生的有機物(AOM). Beuckels等(2013)表明,腐殖酸和藻酸鹽將顯著抑制磷酸鈣誘導的自絮凝,而葡萄糖和乙酸等小分子卻沒有影響.同樣,Wu等(2012)發現AOM對氫氧化鎂誘導的自絮凝有強烈的抑制作用,當AOM從零增加至70 mg · L-1時,小球藻的自絮凝效率從92%降低至7%.其原因很可能是DOM將優先與Ca2+、Mg2+等離子結合,從而阻止了磷酸鈣和氫氧化鎂等沉淀物的產生. 另外,由于DOM本身帶負電,因此會額外增加電性中和所需的絮凝劑用量. 鑒于此,Beuckels等(2013)指出,DOM的抑制作用很可能是很多實際情況下,磷酸鈣/氫氧化鎂等沉淀物的相關生成條件都已超過臨界值,但自絮凝卻沒有發生的原因所在.在這方面迫切需要更進一步的系統研究.
5 各種絮凝分離方法的比較與展望
以鐵鹽和鋁鹽為代表的金屬絮凝劑是各種絮凝方法中應用最為成熟的技術.其主要優點是藥劑生產簡單,絮凝條件容易控制,絮凝效果有保障. 但無機絮凝劑的用量一般很大(幾百mg · L-1藻液),從而產生大量污泥. 再者,絮凝效果受pH影響較大,其最佳pH值很可能超出微藻培養系統的正常pH范圍,且無機絮凝劑僅對部分微藻種屬有效. 最不利的效果是,金屬鹽類往往對藻細胞具有毒害作用: Chen等在使用硫酸鋁和氯化鐵絮凝柵藻時發現,當投加量較高時,藻細胞在24 h后全部死亡;Papazi等也發現鋁鹽雖然絮凝效果最好,但會引起藻細胞裂解.此外,金屬鹽類殘留在藻細胞中還將對藻細胞的利用和最終處置造成不利影響.因此,從微藻培養的角度來看,金屬鹽類絮凝劑并不是最佳的技術選擇. 有鑒于此,無機金屬絮凝劑似乎不可能成為微藻分離采收的主要發展方向.
與無機絮凝劑相比,有機高分子絮凝劑具有更高的絮凝效率(10~30 mg · L-1藻液),產生的污泥量小,能適用于更廣泛的微藻種屬.其中,聚丙烯酰胺雖然是水處理中應用最成熟的高分子絮凝劑,但其對微藻的絮凝效果卻不如殼聚糖、陽離子淀粉等天然高分子絮凝劑. 且其在使用中可能會釋放出一定量具有強烈毒性的單體丙烯酰胺,因此其應用前景有限. 天然高分子絮凝劑無毒,易生物降解,對微藻培養和藻細胞的后續利用基本無負作用,在微藻的分離采收中具有良好的應用潛力. 但天然高聚物中只有殼聚糖等少數是陽離子型的. 殼聚糖的絮凝效率很高,但其絮凝條件一般為酸性,超出了微藻生長的正常pH范圍. 考慮到對大量藻液進行酸化所需投加的化學藥劑用量,殼聚糖很可能在經濟上不具備選擇性. 陽離子淀粉在原料上可大量獲取,價格低廉,投加量非常小(幾mg · L-1藻液),絮凝效果優異且基本不受pH影響,具有良好的工程化應用潛力. 后續研究的重點應在于優化其陽離子化過程,以進一步提高其適用性和絮凝效率,并顯著降低加工制造成本.
利用細菌、真菌等微生物生產的生物絮凝劑具有高效、無毒、可生物降解等優點. 但其各種利用方式都存在明顯缺陷:1)直接投加微生物細胞或菌-藻共同培養有對微藻培養系統造成污染的風險;2)投加培養液、抽取液、提取物等方式需要一個微藻培養系統以外的單獨培養體系,尤其是后兩者還涉及到復雜的分離和加工問題,這無疑會增加利用難度和成本. 可見,生物絮凝劑一般所宣稱的低成本優勢可能在實踐中難以能成為現實. 生物絮凝劑另一缺點是,某一生物絮凝劑可能只對某些特定藻種絮凝效果較好. 利用自絮凝藻種產生的生物絮凝劑不需要額外的培養體系,且無污染微藻培養之虞. 但自絮凝種屬的生長速度一般低于非自絮凝種屬,其污水凈化能力和產油潛力也可能不如非絮凝藻種.因此,控制自絮凝藻種在系統中的比例至關重要. 這就提出了在混合培養中進行種群控制的復雜要求. 與細菌、真菌等微生物產生的生物絮凝劑類似,自絮凝藻株的絮凝效果也將隨目標藻種的不同而異. 理解自絮凝(EPS誘導)藻種的絮凝機理對促進其應用具有關鍵意義. 目前在這方面的研究還非常不足,基本上還處于對EPS的成分分析上. DCB理論雖然能解釋很多實驗現象,但存在不能解釋為什么只有特定藻種才具有絮凝作用這一根本缺陷. 在此方面,由藻細胞親/疏水性決定的Lewis酸-堿水合作用力是非常有前景的理論,應該成為后續研究的重點.
氫氧化鎂沉淀雖然能有效誘導出自發性絮凝,但其形成一般要在pH>10.5以上. 而大部分微藻在pH>9時光合作用就會受到顯著抑制甚至完全停止,所以微藻的自然生長很可能達不到氫氧化鎂沉淀的生成條件. 事實上,幾乎所有基于氫氧化鎂沉淀的自絮凝都是通過外加堿性物質達到所需pH值(表 6),這無疑會帶來額外的成本. 高pH還可能對藻細胞造成嚴重損傷,例如,高產油藻種Skeletoma costatum在pH = 10. 2時絮凝率達 80%,但回收藻體中相當一部分細胞發生解體及胞內成分外泄,嚴重影響后續二十碳五烯酸(EPA)提取工藝;螺旋藻(Spirulina platensis)在pH高于13時,細胞絮凝得又快又徹底,但此時藻細胞顏色發黃,表明其細胞已受到較為嚴重的“pH損傷”.此外,高pH值還很可能超出排放標準,需要再加酸調節到容許的范圍. 因此,基于氫氧化鎂沉淀的自絮凝只適用于單純的微藻采收,對微藻污水處理系統來說并不是一個合適的選擇.
基于磷酸鈣沉淀的自絮凝無需任何額外投入,在微藻自然生長的pH范圍內(8~10)就能形成,能同步實現除磷,對微藻活性和藻細胞的后續加工利用幾乎沒有不利影響. 因此,無論是從污水深度處理,還是從藻細胞的采收利用等角度來看都是最合適的分離采收方法之一. 尤其是隨著磷酸鹽濃度提高,其臨界pH值將顯著下降;而這在實際污水處理中恰恰是一個很容易控制的工藝條件. 鑒于此,可以提出以下幾個強化基于磷酸鈣沉淀自絮凝的思路:①在污水處理的主體工藝中取消強化生物除磷,為后續微藻處理系統保留高磷濃度;②采用高密度間歇培養方式,并完全或在反應周期末端取消外部CO2供給,以迅速且自然地形成高pH條件;③通過適當延長反應周期、強化光合作用(光照、底物濃度)等進一步促進pH的提升. 目前存在的問題是大部分研究都只是考察高pH下瞬時的絮凝效果. 如果微藻培養系統長期處于誘導自絮凝所需的高pH環境,幾個非常值得關注的問題是:①微藻種群結構是否會發生顯著變化?② 目標藻種能否維持優勢?③ 微藻的生理特性(凈化能力、油脂含量等)是否會發生改變?這些都需要進一步的系統研究來明確.
6 結論
用于微藻分離、采收的理想絮凝劑應該具有無毒(對藻細胞本身及環境)、低成本、廣譜高效、不影響藻細胞后續利用等特點. 依此標準,金屬鹽類絮凝劑因投加量大、對藻細胞有毒性及影響藻細胞的后續利用等缺點不能成為微藻絮凝的主要發展方向. 有機高分子絮凝劑中聚丙烯酰胺對微藻的絮凝效果較差,可能釋放有毒的丙烯酰胺單體,因此其應用前景有限. 殼聚糖絮凝效率較高,但適應的絮凝pH一般為酸性,超出了微藻培養的正常范圍,具有很大的局限性. 而陽離子淀粉在原料上可大量獲取,價格低廉,投加量非常小,絮凝效果優異且基本不受pH影響,具有良好的工程化應用潛力. 后續研究的重點應在于優化其陽離子化過程,以進一步提高其適用性和絮凝效率,并顯著降低加工制造成本.
利用細菌、真菌等微生物生產的生物絮凝劑具有高效、無毒、可生物降解等優點. 但其各種利用方式都存在明顯缺陷,例如,可能對微藻培養造成污染,需要額外的培養系統,涉及到復雜的分離純化過程等. 此外,生物絮凝劑的絮凝機理和條件都還不甚明確. 因此,生物絮凝劑距工程化應用還存在很大距離. 同理,基于胞外聚合物的微藻自絮凝因絮凝機理復雜、絮凝條件不明確及涉及到復雜的種群控制要求等,可靠性較差,在微藻絮凝分離中可能只能起到錦上添花的作用.
具體參見污水寶商城資料或http://www.bnynw.com更多相關技術文檔。基于氫氧化鎂沉淀的自絮凝要求很高的pH值(>10.5). 這往往超出微藻正常生長所能達到的pH值范圍,需要額外投加堿性物質,可能對藻細胞的活性和后續利用造成不利影響,因此,對微藻污水處理系統可能并不是合適的選擇. 基于磷酸鈣沉淀的自絮凝無需任何額外投入,在微藻自然生長的pH范圍內(8~10)就能形成,能同步實現化學除磷,對微藻活性和藻細胞的后續加工利用幾乎沒有不利影響. 因此,無論是從污水深度處理,還是從藻細胞的采收利用等角度來看都是最合適的分離采收方法之一. 后續研究應進一步明確其形成條件,并結合污水處理主體工藝的調整(取消強化除磷)、微藻培養方式的改進(高密度間歇培養、取消CO2供給,調節反應周期)等對其進行強化. 此外,還應重點關注微藻培養系統長期處于高pH條件下可能發生的種群結構和生理特性變化.