1 引言
隨著金屬冶煉、采礦、塑料、電鍍、皮革業等行業的迅猛發展, 含鎘廢水的排放量劇增, 鎘污染問題頻現.人類在攝入一定量的鎘元素后可患癌、致畸, 并對人體內多種酶產生影響.與此同時, 隨著環境重金屬污染問題的加劇, 對于重金屬污染的治理已迫在眉睫.
廢水中重金屬的處理方法主要分為物理法、化學法、生物法等, 近年來, “綠色”治理逐漸興起, 而其中的固定化微生物修復技術因具有二次污染小、吸附率較高、環保經濟、應用前景好等優點, 被頻繁地應用于重金屬、有機污染廢水治理中, 符合綠色治理的概念, 成為近年水處理技術的熱門發展方向.
目前, 用于固定化技術的微生物主要有黃孢原毛平革菌、白腐真菌、釀酒廢酵母菌、魯氏酵母菌、多黏類芽孢桿菌、硫酸鹽還原菌、簡青霉菌、黑根霉菌等;常見的固定化載體包括海藻酸鈉、聚乙烯醇、殼聚糖、生物炭、生物材料(如秸稈、絲瓜囊等).也有研究人員將磁性納米顆粒進行混合用于固定化, 制得具有一定磁性便于分離的生物吸附劑, 發現其對重金屬的去除效果較好.例如, 徐雪芹等將簡青霉用絲瓜囊固定化后用于吸附廢水中的Pb2+、Cu2+, 吸附率均達到98%, 吸附量分別達到223.36、163.28 mg·g-1;張靜進等海藻酸鈉固定多黏類芽孢桿細菌并用于Pb2+的吸附, 吸附率達到93.74%, 最大吸附量可達到370.37 mg·g-1;昝逢宇等將啤酒酵母菌用海藻酸鈉固定后用于Cu2+、Cd2+的吸附, 其吸附率維持在80%以上, 實際最大吸附量分別可達66.58、75.41 mg·g-1.超累積植物內生菌作為一類能定殖于超累積植物組織間隙或細胞內部的細菌、真菌, 對重金屬具有強耐受性, 是一類很有應用潛力的微生物, 目前的研究主要是將其與各類超累積植物聯合修復重金屬污染廢水、底泥、土壤, 暫沒有將其用于微生物固定化技術的報道.納米Fe3O4顆粒作為一種新型的納米材料, 具有容易制備、磁性強、易于分離、比表面積大、對重金屬離子吸附力強等優點, 逐漸成為人們重點關注的研究對象.近年來, 研究人員將納米Fe3O4顆粒進行各種改性以期能更充分地發揮其優勢, 并將其應用于固定化微生物中以達到耐用、處理效率高、克服傳統材料難回收、難分離等缺點的目的.
因此, 本實驗將磁性納米Fe3O4顆粒進行二氧化硅改性后, 聯合海藻酸鈉包埋固定從超累積植物龍葵體內提取得到的植物內生菌Bacillus nealsonii, 制得一種新的生物吸附劑, 以去除水中的Cd2+, 并對最佳制備條件及影響因素進行研究, 同時, 對吸附過程中的吸附動力學、吸附等溫模型進行探究, 以了解吸附過程中的吸附機理.
2 材料與方法
2.1 微生物的來源
實驗所用菌種為本實驗組采用肖瀟等的方法從超累積植物龍葵(采自湖南省衡陽市水口山尾砂庫周邊)體內分離所得.提取得到的微生物對重金屬Cd2+有著較強的耐受性, 最高濃度可達80 mg·L-1.此菌株編號為LRE04, 經16S rDNA序列分析鑒定為芽孢桿菌屬, 命名為Bacillus nealsonii(GenBank序列登錄號為KF535131).
2.2 菌懸液的制備
將從龍葵體內提取的微生物LRE04進行擴大培養.調節種子液培養基pH為7.0, 在立式壓力蒸汽滅菌筒(DY04-13-44-00型)中于0.1 MPa下滅菌30 min.在經過擴大培養的新鮮的內生菌斜面上挑取菌落, 接種到裝有50 mL種子液培養基的100 mL錐形瓶內, 在30 ℃、150 r·min-1的天呈恒溫振蕩器(TS-2102型)中培養24 h, 將此培養液作為植物內生菌LRE04接種時所用的種子液.發酵液培養基pH不需調節, 為自然pH, 將其置于0.1 MPa下滅菌30 min, 在無菌操作條件下以體積分數為2%的接種量接種種子液于含50 mL培養基的100 mL錐形瓶中, 在溫度30 ℃、150 r·min-1下振蕩培養48 h后, 取出置于4 ℃下備用.
2.3 固定化微生物小球的制備
將改性磁性納米顆粒按0.5~2.0 g·L-1的量加入到30~80 g·L-1的海藻酸鈉溶液中, 然后在105 ℃條件下滅菌30~60 min, 最后在無菌條件下冷卻60~90 min, 制得無菌改性磁性納米顆粒與海藻酸鈉混合液;無菌條件下, 在上述溶液中接入微生物懸浮液, 每100 mL混合液中的接種量為0.1~0.8 mL, 充分搖勻混合后得到混合溶液, 將1體積混合溶液漸漸滴到4~10體積的滅菌CaCl2溶液中, 在室溫下靜置一段時間后得到二氧化硅改性磁性納米顆粒+內生菌+海藻酸鈉小球顆粒的反應溶液, 再將固定化微生物小球轉移至100 mL微生物液體培養基中, 30 ℃、150 r·min-1條件下培養4 d.
2.4 正交實驗的設計
改性磁性納米顆粒質量分數、海藻酸鈉質量分數、菌液接種量、交聯時間分別表示為因素A、B、C、D, 各因素的取值范圍及水平設計見表 1.
表 1 各因素的取值范圍及其水平

2.5 固定化微生物小球的結構表征
將在最佳制備條件下得到的生物吸附劑進行冷凍干燥后, 部分進行切片, 通過場發射掃描電鏡(捷克泰思肯, 型號為TESCAN MIRA3)對其表面、內部結構及附著于吸附劑上的微生物進行形態觀察, 以了解制得吸附劑的表面、內部結構及附著于生物吸附劑上的微生物生長狀況.
2.6 吸附試驗
2.6.1 吸附影響因素
配制濃度分別為40、50、60、70、80、90 mg·L-1的Cd2+溶液, 將pH調至3、4、5、6、7, 分別取出50 mL倒入100 mL的錐形瓶中, 加入3、5、10、15 mL (對應干重分別為2.0、2.5、3.0、3.5、4.0 g·L-1)的固定化小球, 將其置于30 ℃、150 r·min-1的恒溫搖床中, 設定好時間, 在不同的實驗條件下進行球狀生物吸附劑的吸附研究.在對應時間吸附后, 定時取樣, 并進行過濾, 取其濾液進行測定.用AAalyst700原子吸收分光光度計測定溶液中剩余金屬離子的濃度, 每個樣品設定3個平行樣, 取其平均值.
2.6.2 吸附動力學實驗
本實驗是在pH為6, 轉速為150 r·min-1, Cd2+濃度分別為5、10、15 mg·L-1的條件下, 吸附720 min過程中考察磁性聚乙烯醇固定化LRE04球狀生物吸附劑對Cd2+的吸附情況, 得出不同時間內吸附劑對Cd2+的吸附率及吸附容量平均值, 再對得到的數據進行線性擬合.
2.6.3 吸附等溫模型實驗
在溫度298、303、308 K下, 向濃度為5~50 mg·L-1的Cd2+溶液中投加對應量的球狀生物吸附劑, 調節溶液pH為6, 在轉速為150 r·min-1的恒溫振蕩器上振蕩相應時間后, 取出離心分離后, 取上清液測量其中Cd2+含量, 設定3組平行實驗, 計算吸附率及吸附量的平均值.
3 結果與討論
3.1 固定化微生物小球的最佳制備條件
采用正交表L9(34)并按照表 1確定的因素及其水平組織實驗, 將Cd2+的吸附率作為考核指標.求出各因素不同水平下的實驗結果之和, 分別以K1、K2、K3表示, 根據其大小來判斷最佳水平.由實驗結果可知, 因素A以水平2最佳, 因素B以水平3最佳, 因素C以水平2最佳, 因素D以水平1最佳;同時, 通過極差R來判斷可知, 各因素的影響大小順序為B>A>C>D, 即吸附劑的最佳制備條件為B3A2C2D1.
綜合上述結果分析可得, 固定化微生物小球的最佳制備條件為改性磁性納米顆粒質量分數0.1%、海藻酸鈉質量分數8.0%、菌液接種量0.4%、交聯時間2 h.
3.2 固定化微生物小球的吸附性能評價
3.2.1 pH對吸附性能的影響
廢液pH值對提取所得的內生菌LRE04及制備得到的固定化微生物小球吸附Cd2+的影響較強, 從圖 1a可看出, 當溶液pH從3增加至6時, 吸附率隨之增加, 當pH達到6時, 吸附率可達最大值89%, pH值為7時, 吸附率下降.由圖 1a還可知, 將微生物進行固定化后制得的小球對重金屬的吸附率較單獨微生物有大幅度的增加, 且固定化微生物小球比微生物活體吸附劑對重金屬溶液的pH有著更強的耐受適應能力.
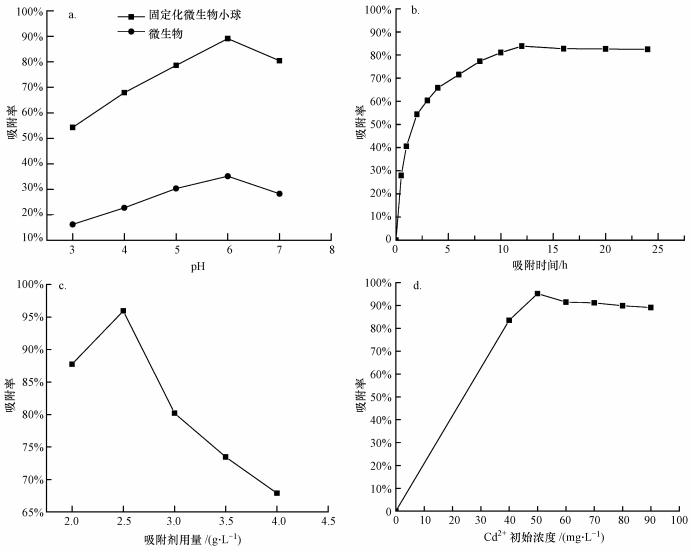
圖 1不同因素對吸附性能的影響(a.pH, b.吸附時間, c.吸附劑用量, d.初始濃度)
固定化微生物小球的表面電荷和電離度極容易受溶液pH影響, 進而影響其化學特性和表面特征.當pH過低時, 水合氫離子(H3O+)會占據附著在小球表面及孔隙中微生物細胞壁的鏈接基團, 產生斥力作用阻礙Cd2+向細胞靠近, 溶液pH值越低水合氫離子(H3O+)越多阻力越大.但隨著pH值升高并超過Cd2+產生微沉淀的上限時, 溶液中的大量Cd2+會以不溶解氧化物、氫氧化物微粒的形式, 使吸附無法進行.本實驗用于吸附的固定化微生物小球是以海藻酸鈉、改性磁性納米顆粒包埋植物內生菌LRE04制得, 相比單一內生菌LRE04而言, 其吸附Cd2+時受溶液pH值影響較小, 也有著相對較高的吸附率.改性磁性納米顆粒因粒徑小、比表面積大、具有磁性等特點, 本身對Cd2+有著較強的吸附能力, 如喬永生等利用二氧化硅改性磁性納米顆粒吸附廢水中的Cd2+, 發現其吸附率可達到91%;黃文等現Fe3O4/SDS納米顆粒對廢水中Cd2+的吸附率可達87%.而固定化微生物小球表面、孔隙均可供內生菌LRE04附著, 從超累積植物龍葵體內獲得的LRE04細胞表面含有羧基和羥基, 能螯合轉化吸附Cd2+, 本身對Cd2+有著一定的吸附、轉化作用.固定化微生物吸附劑的吸附率是單獨微生物的2.6倍.
3.2.2 吸附時間對吸附性能的影響
由圖 1b可知, 吸附時間對固定化微生物小球處理含鎘廢水有著相對大的影響, 在前12 h內屬于快速吸附, 其速率相對較大;在12 h后吸附速率逐漸減小直至不變, 吸附過程基本趨于平衡;在12~24 h間, 溶液中Cd2+濃度的變化不大, 說明固定化微生物小球表面及孔隙的吸附點被充分占據.固定化微生物小球表面孔隙、附著內生菌衣鞘、細胞壁對Cd2+的吸附起很大作用, 有一部分Cd2+也可通過微生物離子轉移系統進入內生菌內部轉化成其他無毒化合物.
3.2.3 吸附劑用量對吸附性能的影響
在Cd2+初始濃度為50 mg·L-1、生物吸附劑用量(干重)分別為2.0、2.5、3.0、3.5、4.0 g·L-1的條件下, 考察吸附劑用量對吸附過程的影響, 結果如圖 1c所示.由圖可知, 隨著吸附劑用量的增加, 吸附劑對Cd2+的吸附率逐漸升高, 吸附劑用量從2.0 g·L-1增長到2.5 g·L-1時, 吸附率從82%增加到96%.
固定化小球表面吸附位點會隨著吸附劑用量的增大而增加.同時, 吸附效率的增加也與吸附位點和Cd2+之間的濃度梯度差有關, 濃度差使得固定化微生物小球對Cd2+的吸附動力增加.但吸附劑用量增加到一定程度后, 吸附率開始減小, 首先吸附劑用量增加會使得固定化微生物小球產生團聚, 吸附劑的有效表面積增加有限, 從而導致吸附容量的下降, 使得部分固定化微生物小球達不到飽和吸附狀態.
3.2.4 離子初始濃度對吸附性能的影響
一般而言, 重金屬離子的吸附過程與重金屬離子濃度/生物量之比有關, 增大重金屬離子的初始濃度可以使得吸附劑的吸附量增加.在低濃度重金屬離子存在的條件下, 金屬離子的濃度越高, 則吸附劑表面吸附位點更容易被占滿, 吸附劑的利用率較高, 吸附劑的吸附率逐漸增加, 單位數量吸附劑所吸附的金屬的量也比較大.但當重金屬離子濃度超過一定濃度時, 吸附位點飽和度也會增加, 空的結合點逐漸減少, 吸附量會因為吸附劑表面吸附位點的飽和而不再繼續增加, 反而會降低重金屬離子的吸附率.而且, 在活體細胞吸附重金屬的過程中, 增加金屬離子的濃度會增大對生物的毒性, 會影響甚至抑制生物體的生長及代謝活動, 從而抑制吸附過程的進行.從圖 1d可以看出, Cd2+初始濃度從40 mg·L-1升至50 mg·L-1時, 該吸附劑對Cd2+的吸附率增加并達到最高, 吸附率達90%以上, 有著很好的去除效果;當Cd2+濃度大于50 mg·L-1時, 吸附劑的吸附率下降.
綜上來看, 在pH為6, 吸附時間達到12 h, 吸附劑用量為2.5 g·L-1(以干重計), Cd2+初始濃度為50 mg·L-1時, 固定化小球對Cd2+的吸附率最佳, 可達96%, 與其他吸附劑對Cd2+的吸附率(如黃沅清等用氨三乙酸酐改性纖維對Cd2+的吸附率最高達90.6%, 朱健等用復合改性的硅藻土對Cd2+的吸附率最高達76.5%)相比, 本研究所制得的這種新型球狀生物吸附劑對于Cd2+的吸附能力處于一個較高的水平.
3.3 掃描電鏡觀察結果
從圖 2a、2b可以看出, 此種生物吸附劑的表面及內部的孔隙很多, 增加了吸附劑內部及表面的孔隙率、比表面積, 很利于吸附劑對廢液中Cd2+的吸附、富集.從圖 2c可看到, 吸附劑所附的微生物生長狀況較好, 很牢固地附著于吸附劑表面, 增大了比表面積, 有利于廢液中Cd2+的附著及傳輸到內部孔隙中;同時, 吸附劑內部與表面的微生物細胞壁有著較多的官能團(羥基、羧基、氨基等), 這些官能團可對廢液中的Cd2+產生鍵合力, 能很好地吸附廢液中Cd2+.
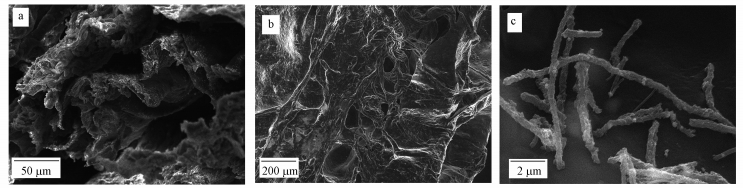
圖 2掃描電鏡圖(a.吸附劑內部結構圖, b.吸附劑表面結構圖, c.吸附劑表面附著微生物)
3.4 吸附動力學
將動力學實驗得到的數據帶入Langergren準一級動力學方程(式(1))和準二級動力學方程(式(2))進行擬合, 擬合得到的參數及結果見表 2.由表 2可知, 對吸附的前60 min數據進行擬合, 發現R2值很高, 不同濃度下的R2分別達到了0.9956、0.9964、0.9972, 說明在前60 min內吸附過程符合準一級動力學.而對于準二級動力學擬合情況, R2值分別達到0.9996、0.9997、0.9994, 比準一級動力學的R2值高.由此可見, 整個吸附過程更符合準二級動力學, 即化學鍵的形成對吸附有著很大影響, 此生物吸附劑對Cd2+的吸附以化學吸附為主.
(1)
(2)
式中, qe為吸附平衡時的吸附容量(mg·g-1);qt為吸附t時刻的吸附容量(mg·g-1);K1為一級吸附速率常數(min-1);K2為二級吸附速率常數(g·mg-1·min-1).
表 2 吸附Cd2+的動力學參數

3.5 等溫吸附模型
在pH為6、溫度為30 ℃、轉速為150 r·min-1的條件下, 配制濃度為5~50 mg·L-1的Cd2+溶液, 做12 h的平衡吸附試驗, 并繪制等溫吸附曲線, 進行等溫模型擬合, 其中, Freundlich等溫吸附模型及Langmuir等溫吸附模型的表達方程如式(3)、(4)及(5)所示.
(3)
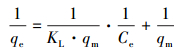
(4)
(5)
式中, qe為吸附平衡時的吸附容量(mg·g-1);qm為吸附劑的最大吸附容量(mg·g-1);Ce為吸附平衡時溶液中Cd2+的濃度(mg·L-1);KL為表征吸附能力的吸附平衡常數(L·mg-1);RL為平衡常數, 判斷反應是否可行;KF為Freundlich吸附容量常數;n為親和常數.
采用Langmuir模型和Freundlich模型擬合的相關參數見表 3.等溫線用Langmuir方程擬合時, 可由擬合相關參數求出RL值.其中, RL是表示吸附劑親和力的一個常數, 0 < RL < 1時, 說明有利于吸附;RL>1時, 說明吸附性能較差;RL=1時, 說明整個吸附過程呈線性關系;RL無限趨于0時, 說明整個吸附過程不可逆.從表 3可以看出, RL值在0~1之間, 說明此生物吸附劑對Cd2+吸附有利, 易于吸附.
表 3 等溫吸附模型參數
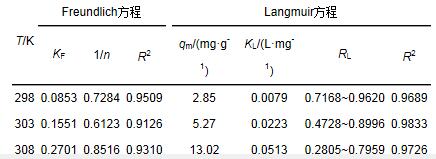
Freundlich模型中的n值是吸附劑吸附作用強弱的指標, 1/n越大, 吸附能力越大.從表 3中可以看出, 隨著溫度升高, 1/n值逐漸增加, 可知隨著溫度升高, 固定化生物吸附劑對Cd2+的吸附作用不斷增強.Freundlich模型通常能較好地描述各種不理想情況下的表面吸附及多分子層吸附.由表 3還可以看出, Langmuir模型與Freundlich模型的R2值均比較大, 說明吸附過程用這兩類模型均能較好地擬合, 但不同濃度下Langmuir模型的R2值均比Freundlich模型的R2值更大, 兩者模型擬合得到的R2分別為0.9509、0.9126、0.9130和0.9689、0.9833、0.9726.因此, 改性磁性納米顆粒固定化內生菌小球對Cd2+的吸附平衡能較好地用Langmuir模型描述, 由此計算得到的最大單分子層吸附量為13.02 mg·g-1.
3.6 固定化微生物小球的解吸特性
為提高固定化小球的利用率, 并回收部分金屬, 需對固定化小球做吸附-解吸實驗, 通過測定其解吸率來確定其可循環利用的次數.本實驗采用1 mol·L-1的HCl作為解吸劑, 在吸附后用無菌生理鹽水洗滌固定化小球3次, 然后用等體積的鹽酸在搖床中進行解吸實驗, 解吸時間為30 min.進行吸附解吸循環5次, 吸附-解吸實驗中所用Cd2+溶液濃度為50 mg·L-1, 實驗結果見表 4.
表 4 吸附劑對Cd2+吸附解吸效果
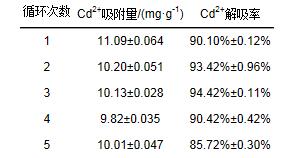
實驗結果表明, 固定化小球吸附-解吸循環5次后, 其吸附率僅比第1次下降了5%, 由此可知, 用改性磁性納米顆粒固定化微生物可高效反復地吸附溶液中的Cd2+, 能有效地循環利用, 循環解吸5次后解吸率仍高達86%左右.具體參見污水寶商城資料或http://www.bnynw.com更多相關技術文檔。
4 結論
1) 改性磁性納米顆粒固定化植物內生菌LRE04吸附劑最佳制備條件為:改性磁性納米顆粒質量分數0.10%、海藻酸鈉質量分數8%、菌液接種量0.4%、交聯時間2 h.
2) 固定化微生物小球對Cd2+有較好的吸附性能.固定化小球最佳吸附條件為pH 6, 吸附時間12 h, 吸附劑用量(干重)2.5 g·L-1, Cd2+初始濃度50 mg·L-1, 此條件下固定化小球對Cd2+的吸附率最佳可達96%.
3) 通過掃描電鏡觀察可以看出, 制備得到的生物吸附劑的內外部結構孔隙率相對較大, 同時, 附著于吸附劑表面的微生物生長狀況良好, 整個吸附劑的結構利于吸附劑對廢水中Cd2+的吸附.
4) 改性磁性納米顆粒固定化植物內生菌LRE04小球對重金屬Cd2+的吸附動力學符合準二級動力學, 以化學吸附為主, 整個過程的吸附平衡能較好地用Langmuir模型及Freundlich模型擬合, 但Langmuir模型的擬合效果更好, 其吸附過程主要為單分子層吸附, 最大吸附量可達13.02 mg·g-1.
5) 解吸結果表明, 固定化小球可高效反復地吸附溶液中重金屬離子, 固定化小球經吸附-解吸循環5次后, 小球吸附能力幾乎不受影響, 能有效的循環利用.


