1 引言
工業快速發展的同時也帶來了大量的環境污染問題,尤其是重金屬由于其不可生物降解性已經成為威脅我國公眾健康的一類重要的污染物.鋅是人體必需的微量元素之一,但如果攝入過量,則會發生鋅中毒,出現惡心、嘔吐、食欲不振、腹部疼痛及免疫力低下等癥狀.因此,為了避免鋅對生態系統及公眾健康造成不良影響,有必要對含鋅廢水進行處理.目前,常見的處理方法有沉降法、離子交換、電化學處理、膜過濾及固化等,但由于相對較高的維護費用和初始資金投入、金屬離子的不完全去除及產生過量污泥等問題限制了這些方法的應用.而吸附法由于具有工藝簡單、成本較低、操作方便等優點,從而展現出很好的應用前景.從環境友好和可持續發展的角度出發,低成本吸附劑被給予越來越多的關注.
高爐渣是冶煉生鐵時從高爐中排出的副產品,現在大多數高爐渣都屬于高爐水淬渣(WBFS),它是在高溫熔融狀態下經過水淬急冷而形成的細小顆粒.目前,高爐渣主要用于生產水泥及作為道路基層材料使用,停留在簡單的低附加值生產開發層面上.因此,如果可以利用高爐水淬渣的特性,將其作為一種吸附材料用于重金屬廢水處理,使高爐水淬渣資源化,將達到以廢治廢的目的.
縱觀國內外文獻,對于高爐水淬渣吸附重金屬的研究較少,尤其缺乏從熱力學和動力學角度對Zn2+在高爐水淬渣上吸附行為的研究.因此,本研究選擇Zn2+為吸附對象,研究高爐水淬渣吸附該重金屬的平衡、熱力學和動力學特征,這將對開發高爐水淬渣作為一種低成本吸附劑處理重金屬廢水的應用研究具有重要意義.
2 材料與方法
2.1 實驗材料
實驗所用高爐水淬渣取自內蒙古包頭鋼鐵集團煉鐵廠.實驗前首先將高爐水渣用去離子水沖洗干凈以去除表面的雜質,在100~105 ℃下干燥24 h,然后將其粉碎,過100目分樣篩,裝入聚乙烯塑料袋自封袋中備用.
2.2 化學試劑
將Zn(NO3)2 · 6H2O(分析純)溶解于去離子水中,配成20~300 mg · L-1的溶液.
2.3 實驗儀器
電感耦合等離子體質譜分析儀(ICP-MS,P-5000,日本Hitachi公司),比表面積測定儀(SA 3000,美國Beckman Coulter公司),電子掃描顯微鏡(SEM,QUANTA400,美國FEI公司),X射線衍射儀(XRD,D8 ADVANCE,德國BRUKER公司),原子吸收分光光度計(AA-6300C,日本 SHIMADZU公司),數顯鼓風干燥箱(GZX-9140 MBE),密封式制樣粉碎機(GJ-3),回旋振蕩器(HY-B2),水浴恒溫振蕩器(SHA-BA).
2.4 實驗方法
2.4.1 高爐水淬渣的重金屬浸出濃度
依據國標GB 5086 2—1997(固體廢物浸出毒性浸出方法—水平振蕩法)制得高爐水淬渣的浸出液,測定爐渣浸出液中重金屬 Cr、Mn、Fe、Co、Ni、Cu、Zn、As、Cd、Pb 的濃度.
2.4.2 吸附等溫實驗
準確稱取1.5 g預處理后的高爐水淬渣放入帶有封口膜的250 mL錐形瓶中,在每個錐形瓶中加入不同濃度(從20到300 mg · L-1)的Zn2+溶液100 mL,并在不同溫度(298、308和318 K)、pH為7的條件下,在恒溫水浴振蕩器上以120 r · min-1的轉速反應100 min.
2.4.3 吸附熱力學實驗
將1.5 g高爐水淬渣加入100 mL 濃度為100 mg · L-1的Zn2+溶液中,在298~338 K溫度范圍內,pH為7的條件下以120 r · min-1的轉速反應100 min.
2.4.4 吸附動力學實驗
將1.5 g 高爐水淬渣加入100 mL不同初始濃度(50、100、150 mg · L-1)的Zn2+溶液中,在不同溫度(298、308和318 K)、pH為7的條件下以120 r · min-1的轉速反應0~300 min.
所有樣品上清液均通過濾紙過濾,濾液用于測試.每個實驗做3個平行樣并配備空白實驗,下文中所有實驗結果都是除去空白實驗之后的數值.吸附量(Qt)由下式進行計算:
式中,Qt為t時刻的吸附量(mg · g-1);C0和Ce分別為溶液初始濃度和平衡濃度(mg · L-1);V是廢水體積(mL);W為吸附劑質量(g).
2.5 吸附理論
2.5.1 吸附等溫模型
Langmuir吸附等溫模型(式(2))、Freundlich吸附等溫模型(式(4))、Tempkin吸附等溫模型(式(5))、Dubinin-Radushkevich(D-R)吸附等溫模型(式(6))分別如下所示.其中,在Langmuir吸附等溫方程中定義了無量綱的分離因子(RL),RL可以表示吸附過程的性質,如果RL=0,為非可逆吸附;如果0
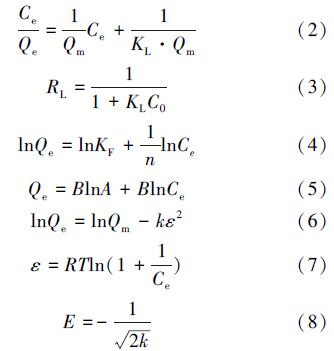
式中,Qe為Zn2+吸附平衡時的吸附量(mg · g-1);Qm為Zn2+的最大吸附量(mg · g-1);C0和Ce分別為Zn2+的初始和吸附平衡時的濃度(mg · L-1);KL為Langmuir吸附常數(L · mg-1);KF (mg · g-1)和n 是Freundlich模型常數;A和B均為Tempkin吸附模型常數;k是與吸附能量相關的常數,ε是Polanyi吸附勢;R 是氣體常數(8.314 J · mol-1 · K-1);T 是絕對溫度(K);E 是平均自由吸附能,當|E|<8 kJ · mol-1,屬于物理吸附,當8<|E|<16 kJ · mol-1,屬于離子交換,當|E|>16 kJ · mol-1,屬于化學吸附.
2.5.2 吸附熱力學
為了測定溫度對吸附過程的影響,需要對熱力學參數吉布斯自由能變(ΔG)、焓變(ΔH)、熵變(ΔS)值進行計算,具體公式如下:
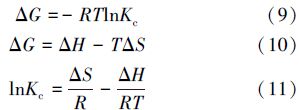
式中,Kc為吸附平衡常數(Kc=Qe /Ce),R和T 的含義同上.
2.5.3 吸附動力學模型
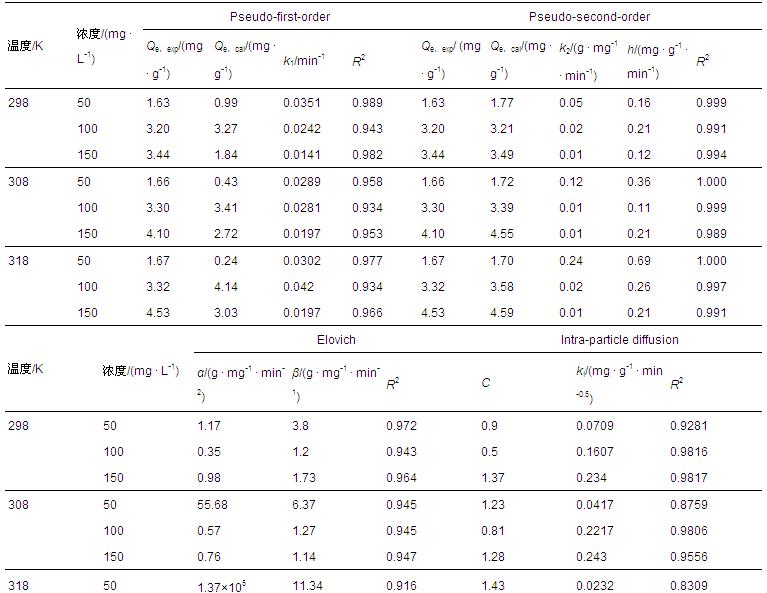
偽一級動力學(Pseudo-first-order)模型(式(12))、偽二級動力學(Pseudo-second-order)模型(式(13))、葉諾維奇(Elovich)模型(式(14))、內部粒子擴散(Intra-particle diffusion)模型(式(15))分別如下所示:

式中,k1為偽一級速率常數(min-1);Qt和Qe分別為Zn2+在t時刻和平衡時的吸附量(mg · g-1);k2是偽二級速率常數(g · min-1 · mg-1),此外,初始吸附速率h=k2Qe2,單位為mg · g-1 · min-1;α和β均為常數;ki是顆粒內擴散速率系數(mg · g-1 · min-0.5);C表示截距.
3 結果與分析
3.1 高爐水淬渣的性質
為了揭示Zn2+在高爐水淬渣上的吸附機理,需要測定高爐水淬渣的性質,具體化學組成及其它特性見表 1.從表 1可以看出,高爐水淬渣主要由CaO和SiO2組成(二者的含量超過66%),當高爐渣投到溶液中,SiO2在溶液中就會以(SiO4)-4的形式存在,(SiO4)-4為晶體結構,這種特殊的晶體結構能夠促進離子交換和吸附作用.此外,在高爐水淬渣中,氧化物總含量相對較高,這也反映出其對金屬離子有較強的親和力.因此,高爐水淬渣可以作為一種針對重金屬離子的吸附劑.

表1 高爐水淬渣的主要化學組成及其它特性
電鏡掃描(SEM)結果見圖 1,從圖中可以看出,高爐渣表面具有粗糙、疏松和多孔的特性.這主要是由于高爐渣在水淬急冷條件下不易使礦物結晶,因而形成大量的具有較高的潛在活性的無定形活性玻璃結構或網絡結構,不存在規則的晶體結構.這些特性對Zn2+在高爐水淬渣上的吸附發揮了重要的作用.

圖1 高爐水淬渣的電鏡掃描圖片
高爐水淬渣的XRD分析結果見圖 2,可以觀察到高爐水淬渣的礦物組成主要有Ca3(Si3O9).整個區域呈現出結晶性差,衍射峰不尖銳,且形成平滑的基線,代表著典型的非晶態結構.

圖2 高爐水淬渣的XRD衍射圖譜
高爐水淬渣中有可能含有一定量的重金屬,為了確保其環境安全性能,需要測定試樣中重金屬的浸出含量,結果見表 2.由表 2可知,高爐水淬渣浸出液中
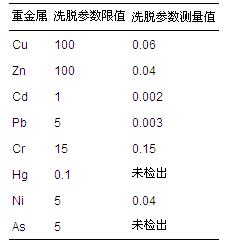
表2 高爐水淬渣浸出液重金屬含量
幾種常見重金屬的濃度均低于國標GB 5085.3— 2007(危險廢物鑒別標準—浸出毒性鑒別)中浸出液最高允許濃度.由此可見,高爐水淬渣的重金屬浸出濃度很低,可以安全地用于廢水處理當中,實現其資源化利用的目的.
3.2 吸附等溫線
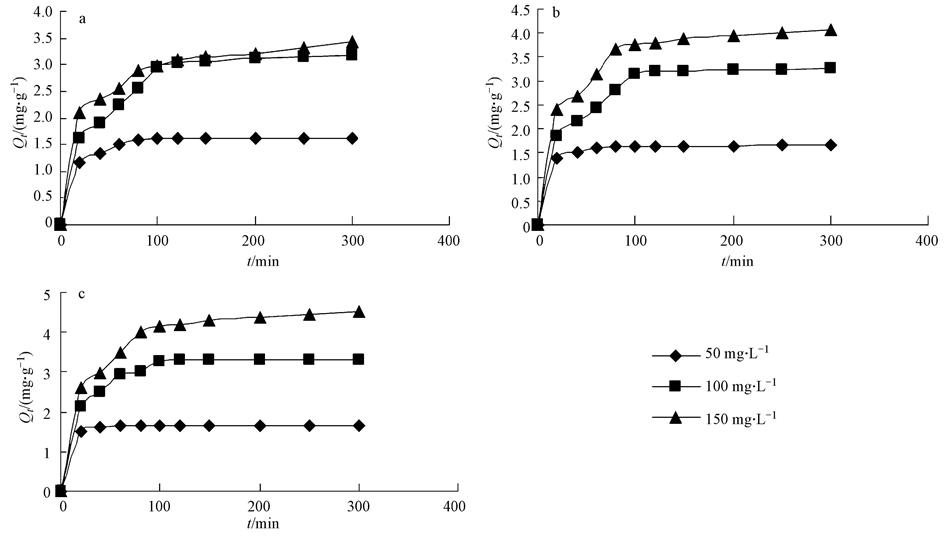
由吸附等溫線的形狀和變化規律可以了解吸附質和吸附劑之間相互作用的強弱,這是如何最優化使用吸附劑的關鍵.圖 3為Zn2+在高爐水淬渣上的吸附等溫曲線.由圖可以看出,該曲線離開原點后向縱軸方向高度凸起,根據對吸附等溫曲線的分類,可將它歸類 為典型的“H”型等溫線,即吸附質對吸附劑具有極大的親和力,即使吸附質溶液濃度極低,吸附劑也能將其大量吸附.實驗過程中,保持高爐水淬渣劑量為1.5 g · L-1,可以看出,隨Zn2+濃度的增加,高爐水淬渣對其吸附量也隨之增加,而且溫度越高,吸附量也越來越高,表明Zn2+在高爐水淬渣上的吸附是個吸熱過程.
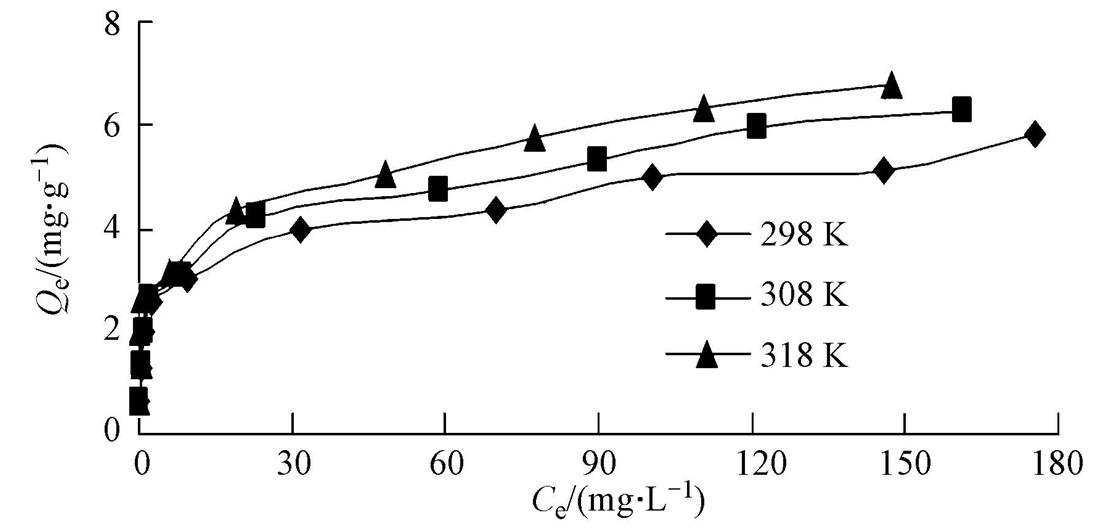
圖3 Zn2+在高爐水淬渣上的吸附等溫曲線
將等溫吸附數據用Langmuir模型、Freundlich模型、Dubinin-Radushkevich(D-R)模型及Tempkin模型進行模擬,用以解釋高爐水淬渣對Zn2+的吸附機理,所得的等溫吸附參數見表 3.從表 3可以看出,Langmuir模型擬合系數(0.9858<R2<0.9882)比其它模型高,可見高爐水淬渣吸附Zn2+的吸附平衡線更符合Langmuir吸附等溫方程,說明此吸附屬于單分子層吸附(張雙圣等,2011).隨著溫度從298 K上升到318 K,Zn2+的最大吸附量(Qm)由5.57 mg · g-1上升到6.61 mg · g-1,Langmuir常數(KL)隨之由0.15 L · mg-1上升到0.21 L · mg-1.因此,升高溫度有利于高爐水淬渣對Zn2+的吸附.分離因子RL值介于0.0134~0.2511之間,表明在298~318 K的溫度范圍內,高爐水淬渣對Zn2+的吸附為有利吸附過程.
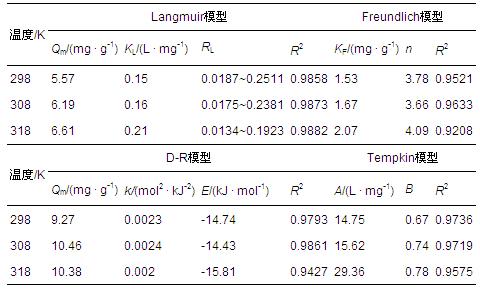
表3 Zn2+在高爐水淬渣上的吸附等溫參數
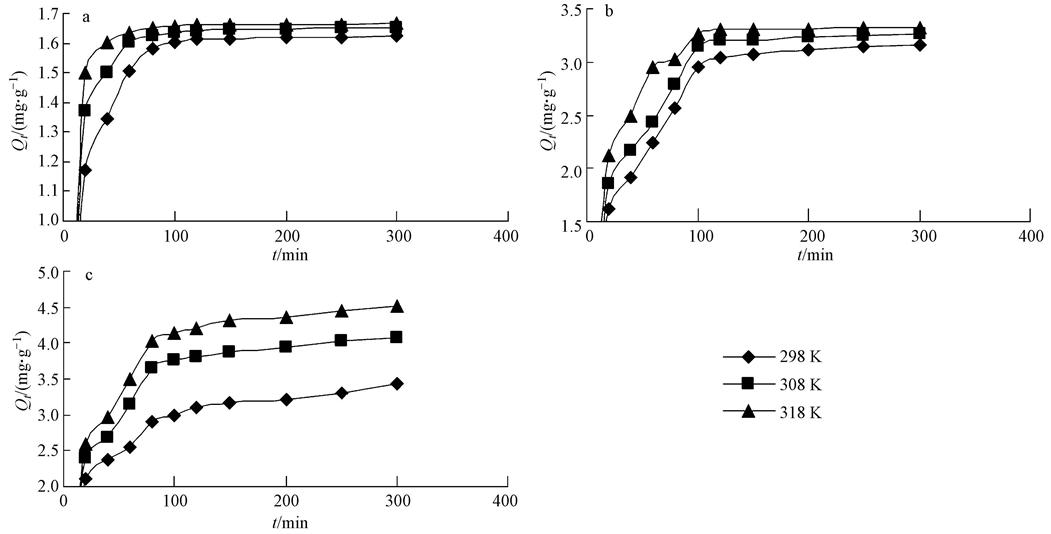
在Freundlich方程中,KF隨著溫度的升高而增大,n值介于1~10之間,說明Zn2+在高爐水淬渣吸附劑上是向著有利于吸附的方向進行.對于D-R模型,當溫度從298 K上升到318 K,最大吸附量(Qm)分別為9.27、10.46和10.38 mg · g-1,這與實驗得到的值存在一定的差異,所以,從D-R等溫式得到的理論最大吸附量被認為不夠準確.隨著溫度的變化,吸附能量E分別為-14.74、-14.43及-15.81 kJ · mol-1.吸附能量的絕對值|E|均位于8~16 kJ · mol-1之間,表明高爐水淬渣對Zn2+的吸附機制以化學反應中的離子交換為主.Tempkin模型適用于吸附熱是隨表面覆蓋度變化而線性下降的化學吸附,從可決系數(0.9575 在298、308、318、328及338 K下,研究溫度對高爐水淬渣吸附Zn2+的影響,各吸附熱力學參數如吉布斯自由能變(ΔG)、焓變(ΔH)、熵變(ΔS)值見表 4.結果表明,隨著溫度的升高,lnKc的值也隨之增大,這說明溫度越高,高爐水淬渣吸附的Zn2+越多,這可能是由于隨著溫度的升高,Zn2+在溶液中的流動性增強,這樣有利于克服位阻,加速吸附的進行,從而增加了吸附劑的吸附容量.ΔG值隨著溫度的升高而逐漸降低,說明在298~338 K的溫度范圍內高爐水淬渣對Zn2+的吸附反應的自發性與溫度成正比,溫度越高,自發性越強,這與吸附等溫線測定的結果是一致的.一般情況下,吸附是放熱過程,而解吸是吸熱過程,在本次研究中ΔH為正值,說明吸附過程為吸熱反應,高溫有利于吸附反應的進行,這可能是由于高爐水淬渣吸附Zn2+的同時也需要解吸多個水分子,而解吸水分子需要吸收的熱量大于吸附Zn2+所釋放的熱量,最終導致整體呈現吸熱過程.一般來說,當0<|H|<42 kJ · mol-1,屬于物理吸附;|H|>42 kJ · mol-1,屬于化學吸附.本研究中ΔH為52.45 kJ · mol-1,屬于化學吸附,這與D-R等溫模型結果一致. 熵變是溶質分子吸附的熵減過程和溶劑分子解吸的熵增過程的總和.本研究中,ΔS值為167.52 J · mol-1 · K-1,是一個正值,說明該吸附為熵增的吸附,水分子脫附引起的熵增超過了Zn2+吸附引起的熵減,固液體系中混亂度變大,這與對ΔH的研究結果相一致. 表4 Zn2+在高爐水淬渣上的吸附熱力學參數 3.4 吸附動力學 為研究接觸時間對Zn2+在不同條件下吸附的影響進行了吸附動力學實驗,不同濃度下Zn2+的吸附量見圖 4.結果表明,在298、308、318 K溫度條件下,各濃度Zn2+隨著吸附時間的延長,吸附量呈現出先增加,然后大約100 min后,廢液中Zn2+的吸附量逐漸趨于平穩,最終達到吸附平衡.這是因為初始階段,高爐水淬渣表面的活性位點較多,濃度梯度較大,傳質的推動力也相應較大,隨著時間的延長,Zn2+濃度變小,傳質推動力相應變小,因此,吸附反應趨于緩慢.從圖中還可以看出,隨著廢水初始濃度從50 mg · L-1增加到150 mg · L-1,Zn2+的吸附量也隨之逐漸增大.這可能是因為初始濃度越高,越容易滿足吸附動力學條件,也越有利于吸附反應的進行,從而導致Zn2+的吸附量也就越高. 圖4 不同初始濃度下接觸時間對Zn2+在高爐水淬渣上吸附的影響(a.298 K,b.308 K,c.318 K) 圖 5展現了初始濃度分別為50、100、150 mg · L-1的Zn2+溶液在不同溫度(298、308和318 K)下的吸附過程.結果表明,各溫度條件下,高爐水淬渣對Zn2+的吸附量在0~100 min內有相對較明顯的升高,100 min以后升高幅度不大,趨于平衡.在初始濃度相同的情況下,吸附量均呈現出在318 K時顯著高于其它溫度的趨勢,這表明吸附程度是隨著溫度的升高而增加,表明該過程是吸熱的. 圖5 不同溫度下接觸時間對Zn2+在高爐水淬渣上吸附的影響(a.50 mg · L-1,b.100 mg · L-1,c.150 mg · L-1) 為了更好地探究吸附特征,本文采用偽一級動力學(Pseudo-first-order)、偽二級動力學(Pseudo-second-order)、葉諾維奇(Elovich)和內部粒子擴散(Intra-particle diffusion)進行線性擬合,所得動力學參數值見表 5.單就這些模型隨著Zn2+濃度從50 mg · L-1到150 mg · L-1的可決系數而論,二級動力學模型擬合效果最好,而且計算得到的Qe,cal也更接近實驗中測得的Qe,exp.只是因為偽二級動力學方程與偽一級動力學方程相比在作圖擬合過程中不需要先測得平衡吸附量,這樣可以減少誤差(岳欽艷等,2007).另外,偽二級動力學模型包含了Zn2+由溶液經液膜擴散到高爐水淬渣表面,然后Zn2+在水淬渣外表面和內表面吸附位點發生吸附反應,以及Zn2+在高爐水淬渣顆粒內部的擴散反應的整個過程,所以能夠更為真實地反映Zn2+在高爐水淬渣上的吸附機理.因為偽二級動力學方程認為影響吸附的主要因素是化學鍵的形成,所以認為高爐水淬渣對Zn2+的吸附以化學吸附為主.從表 5還可以看出,同一溫度下,偽二級吸附常數k2隨初始濃度的增大而逐漸減小,說明k2值的大小取決于Zn2+的初始濃度值.因此,也就意味著Zn2+初始濃度高的反應相對于低濃度的需要較長時間以達到反應平衡. 表5 Zn2+在高爐水淬渣上的吸附動力學參數 依據偽二級動力學模型計算得出k2值,利用Arrhenius公式:k2=Ae-(Ea/RT)計算活化能Ea,其中,R是理想氣體常數,T為溫度,A為常數,以lnk2 對1/T作圖,根據斜率計算活化能為61.85 kJ · mol-1.一般物理吸附的活化能為5~40 kJ · mol-1,而化學吸附的活化能一般為40~800 kJ · mol-1,由計算結果可知,高爐水淬渣吸附Zn2+屬于化學吸附.加而逐漸變大,表明Zn2+初始濃度越大,其在高爐水淬渣顆粒內部越容易擴散,這可能是因為濃度越大,由濃度梯度引起的推動力越大造成的.由數據的分析得知,截距C都不為零,這說明擬合曲線都沒有經過原點,也就是說顆粒內擴散速率不是控制高爐水淬渣吸附Zn2+的唯一速率,而是由膜擴散和顆粒內擴散的速率共同決定的.Elovich方程的可決系數在0.9162~0.9828之間,擬合程度較高,隨著濃度和溫度的變化,擬合常數都有波動,但變化不是很規律. 4 結論 1)高爐水淬渣吸附Zn2+的吸附等溫線符合Langmuir模型,主要為單分子層吸附.D-R吸附模型結果表明,高爐水淬渣對Zn2+的吸附機制以化學反應中的離子交換為主. 2)熱力學研究表明,高爐水淬渣對Zn2+吸附的自發性與溫度成正比,是一個吸熱熵增過程,而且|H|>42 kJ · mol-1,故屬于化學吸附. 3)隨著接觸時間的延長,初始濃度越大,反應溫度越高,高爐水淬渣對Zn2+的吸附量越大.吸附動力學符合偽二級動力學模型,反應活化能為61.85 kJ · mol-1,屬于化學吸附.具體參見污水寶商城資料或http://www.bnynw.com更多相關技術文檔。 以上研究表明,高爐水淬渣作為煉鐵廠的廢棄物,可以作為一種低成本吸附劑,在處理廢水中的重金屬污染物方面具有較好的去除效果,并具有潛在的研究價值.但還需要進一步的研究來獲得更多關于高爐水淬渣和重金屬污染物相互作用的理論基礎知識.