二硝基重氮酚(DDNP)生產時產生的重氮鹽廢水含有多種有毒有害物質,其成分復雜,有很強的染色性且難于處理〔1, 2〕,成為DDNP生產的瓶頸。已有學者針對該種廢水相繼開發出多種處理技術,但處理效果均不十分理想。
微電解工藝利用鐵屑中的鐵和顆粒炭組分分別構成微原電池的正極和負極,以充入的廢水為電解質溶液,通過氧化-還原反應對廢水進行處理,其具有成本低廉、效果好的特點,在印染、石化和制藥等化工廢水的治理中有較多應用〔3, 4, 5〕。Fenton試劑氧化法是利用H2O2在Fe2+催化作用下生成氧化能力很強的羥基自由基(·OH)〔6〕,·OH可無選擇地氧化水中的多數有機物,具有反應迅速、無二次污染等優點,已被更多應用于難降解廢水的處理當中〔7, 8, 9, 10〕。將微電解工藝與Fenton高級氧化法耦合,能夠彌補微電解工藝填料易鈍化、板結現象和Fenton高級氧化法成本高的不足。近年來,微電解-Fenton組合工藝已較多地應用于TNT廢水、硝基苯廢水和垃圾滲濾液等有害廢水的處理中〔11, 12, 13〕,但是在DDNP廢水的處理上還鮮有報道。筆者通過實驗確定了微電解-Fenton耦合預處理DDNP廢水的最佳工藝條件,以期在生物處理前更經濟高效地提高DDNP廢水的可生化性,便于后續的處理。
1 實驗部分
1.1 實驗材料
實驗用水:以遼寧省某化工廠的DDNP混合生產廢水為原水,將其稀釋4倍后作為實驗用水,廢水呈黑褐色,COD為1 996.4~2 008.2 mg/L,pH=9.8。
試劑:質量分數為30%的雙氧水、硫酸亞鐵、硫酸銀、濃硫酸、重鉻酸鉀、硫酸亞鐵銨、鄰菲羅啉、氫氧化鈉,以上均為分析純;鐵炭填料。
設備:pH-2011型pH計,深圳科迪達有限公司;85-2型恒溫磁力攪拌器,常州國華電器有限公司;Sp-780型曝氣器,中山市日盛電器制品有限公司;DL-1型電子萬用爐,北京市永光明醫療儀器廠;FC204型電子天平,上海精科天平廠;102型電熱鼓風干燥箱,山東龍口市先科儀器公司;Fuhe600型恒溫水箱,金壇富華儀器有限公司;榮升269/HC型冰箱,海信科龍電器股份有限公司。
1.2 實驗方法
實驗包括微電解靜態實驗、Fenton靜態實驗、微電解-Fenton耦合靜態實驗、微電解-Fenton耦合動態實驗。
微電解和Fenton靜態實驗運用正交實驗法和單因素實驗法。先通過正交實驗確定影響實驗效果因素的主次順序,然后進行單因素實驗。反應均為燒杯實驗,微電解實驗在500 mL燒杯中進行,鐵炭填料位于燒杯底部,曝氣頭埋放在填料中,曝氣量由微型曝氣器控制,300 mL實驗廢水將填料完全淹沒。靜態Fenton燒杯實驗在250 mL燒杯內進行,實驗過程中采用磁力攪拌器攪拌。
微電解-Fenton耦合靜態實驗是微電解后接續Fenton氧化。實驗廢水在微電解一定時間后取上部出水,加入H2O2,并考察不同條件下COD的去除率。
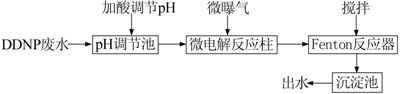
微電解-Fenton耦合動態實驗采用圖 1所示工藝流程。
圖 1 微電解-Fenton耦合工藝流程
實驗廢水經pH調節后,連續從高位水箱的底部進入一內填充規整化鐵炭填料的動態反應柱內,反應柱的底部裝有微曝氣裝置。微電解反應柱尺寸為D 80 mm×260 mm,壁厚5 mm,有效容積約1.15 L,其中填料填充約一半體積;通過閥門控制流速以達到預設的停留時間。微電解出水進入Fenton反應器底部,在攪拌的同時,于反應器中部加入H2O2, Fenton反應器最大有效容積為0.5 L,反應一定時間后出水進入沉淀池,加NaOH沉淀后得到最終出水。設計的動態反應裝置均采用底部進水,上部出水、廢水依靠重力逐級進入下一級反應。
1.3 分析方法
COD的測定采用重鉻酸鉀法(GB 11914—1989)。
2 微電解預處理實驗結果
2.1 正交實驗
選取影響較大的pH、反應時間、溫度、液固比條件進行四因素三水平的正交實驗,pH選擇2、4、6;反應時間選擇1、2、3 h;溫度選擇15、30、45 ℃;液固比選擇6∶1、3∶1、2∶1。
每次取實驗廢水300 mL于500 mL燒杯中,加入鐵炭填料,按正交實驗表控制實驗參數進行正交實驗,通過正交實驗結果和極差分析得出,上述各因素影響程度依序為:pH>液固比>反應時間>溫度。因反應溫度影響不顯著,且考慮到工程實踐中溫控時的能量消耗較大,因此確定微電解處理DDNP廢水的最佳條件為:pH=2,液固比2∶1,反應時間3 h,室溫(20 ℃)。為進一步驗證最優工藝條件,分別對各因素進行單因素實驗。
2.2 單因素實驗
2.2.1 廢水初始pH的影響
取300 mL實驗廢水于燒杯中,初始pH分別調整為1、2、3、4、5、6、7,液固比為2∶1,反應時間為3 h,反應結束后用NaOH調節出水pH至8~9,沉淀后過濾,取濾液測定不同pH對COD的處理效果。實驗結果表明,COD去除率隨pH的升高呈下降趨勢。因pH越低,鐵更容易以離子形態存在,且由于Fe2+的不斷生成,能有效克服陽極的極化作用,從而促使鐵的電化學腐蝕,因此考慮實際成本問題,選擇初始pH=2較有利。
2.2.2 液固比的影響
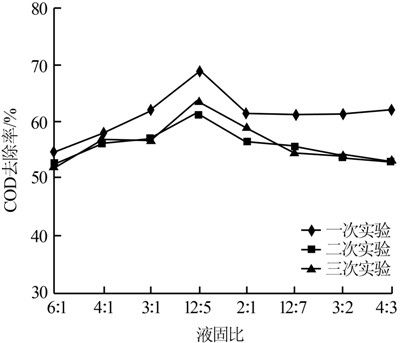
取300 mL實驗廢水于燒杯中,室溫下調節廢水初始pH=2,設定液固比分別為6∶2、4∶1、3∶1、12∶5、 2∶1、12∶7、3∶2、4∶3,反應時間3 h,3組平行實驗結果見圖 2。
圖 2 液固比對COD去除率的影響
由圖 2可以看出,隨著液固比的增大,COD去除率先升高后下降。當液固比小于12∶5時,COD去除率逐漸上升,液固比大于12∶5時,COD去除率先下降后趨于穩定。液固比較大時,即當微電解填料投加量過高時,Fe2+的絕對生成量增加,反應液中瞬間積存大量的Fe2+,致使COD升高。同時微電解填料用量太多,在實際運行時易堵塞,從而增大損失,成本也高。因此選擇液固比為12∶5。
2.2.3 反應時間的影響
取300 mL實驗廢水于燒杯中,室溫下調節廢水初始pH=2,設定液固比為12∶5,選擇反應時間為0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h進行微電解處理效果的對比實驗。實驗結果表明,隨著反應時間的延長,COD去除率不斷上升,但當反應時間超過2.0 h后,COD去除率的增長趨勢開始變緩。在反應初期,隨時間的延長,有機物反應愈加充分,處理效果明顯增加;而隨著反應時間繼續延長,填料鈍化,在其表面會形成一層致密的氧化膜,阻礙反應進行;另外隨著反應的進行,溶液pH升高也不利于微電解反應。因此選擇反應時間以2.0 h為宜,此時實驗廢水的COD去除率可達到60.28%。
3 Fenton預處理實驗結果
3.1 正交實驗
實驗設計了以pH、反應時間、H2O2及FeSO4投加量為主要變量的四因素三水平正交實驗,pH選為3、5、8;反應時間選擇1、2、3 h;H2O2 投加量選擇1、2、3 mL;0.3 mol/L的FeSO4投加量選擇1、2、3 mL。
通過對正交實驗的結果分析,反應過程中各影響因素的順序為:H2O2 投加量>反應時間>初始pH>FeSO4 投加量。正交實驗較優組合為H2O2 投加量為3 mL,反應時間為2.0 h,初始pH=5,0.3 mol/L的FeSO4投加量為3 mL。為了進一步確定最優工藝條件,對各主要因素進行單因素實驗。
3.2 H2O2投加量對處理效果的影響
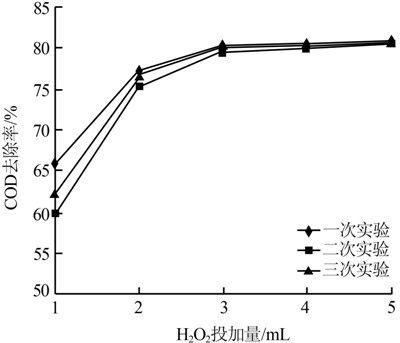
常溫下取實驗廢水100 mL于燒杯中,調節廢水初始pH=5,攪拌的同時依次加入現配的0.3 mol/L FeSO4 3 mL及1~5 mL H2O2,反應2.0 h后檢測COD,3組平行實驗結果見圖 3。
圖 3 H2O2投加量對COD去除率的影響
由圖 3可知,開始階段COD去除率隨H2O2投加量的增加而增加,而當H2O2投加量大于3 mL時,COD去除率增速放緩。究其原因:隨著投加量的增加,生成的·OH也會隨之增加,且所產生的·OH全部參與了與有機物的反應,系統對COD的去除率相應增加;而當H2O2的投加量增加到一定程度,過量的H2O2與·OH反應生成 H2O和O2,抑制了對有機物的降解,且因O2的釋放會使反應中的沉淀上浮,影響出水水質。當H2O2投加量為30 mL/L時,處理效果最佳。
3.3 反應時間對處理效果的影響
足夠的反應時間能保證對難降解有機物氧化分解更徹底。Fenton試劑的反應時間主要由羥基自由基的產生速率和有機物的反應速率所決定。有文獻證實,Fenton反應是一種與緩慢的生物反應不同的“瞬時”化學反應,Fenton氧化過程中COD的變化可以用一級反應動力學模型來描述〔14〕。在考察反應時間對處理效果的影響時,取100 mL實驗用水,調節廢水初始pH=5,H2O2投加量為3 mL,FeSO4 投加量為3 mL,在對整個實驗過程分析發現,隨反應時間(t)的延長,COD去除率先逐漸升高,在2.0 h時左右達到79.75%,其后緩慢上升。經擬合,方程為y=1-0.563 1exp(-0.300 1t)(y為COD的去除率),R2= 0.941,這與一級反應動力學模型較為吻合。
3.4 廢水初始pH及FeSO4投加量對處理效果的影響
在其他實驗條件均不改變時,通過改變廢水初始pH及FeSO4投加量進行單因素實驗,實驗結果表明,當pH=5時,COD去除率最高。過高的pH,會抑制·OH產生,同時也會使溶液中Fe2+以氫氧化物的形式沉淀而失去其催化能力;而當pH過低時,在氧化環境中Fe2+可能會轉變成Fe3+、FeOH2+等形式,降低其催化效果。而FeSO4用量在30 mL/L時,COD去除率達最高,為80.54%。
4 微電解-Fenton耦合靜態實驗結果
在分析微電解和Fenton高級氧化處理技術的基礎上,試圖將兩者結合起來,形成綜合的處理工藝,并考察微電解-Fenton耦合作用的效果。因微電解出水時的pH在4.5左右,接近Fenton反應最佳pH,故在下面的耦合實驗中不再考慮pH的影響。
4.1 H2O2投加量對處理效果的影響
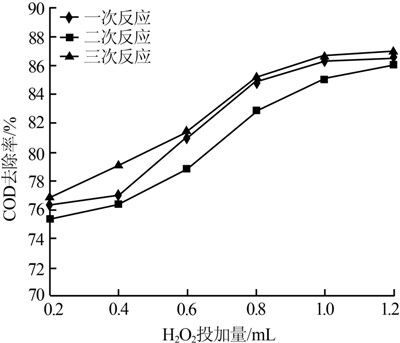
先進行兩組平行微電解實驗,廢水的初始pH=2,液固比為12∶5,反應2.0 h后取6份100 mL出水,依次加入不同投加量的H2O2,反應2.0 h后調節出水pH為8~9,靜置沉淀,測定上清液COD的去除率,3組平行實驗結果見圖 4。
圖 4 H2O2投加量對耦合反應COD去除率的影響
由圖 4可以看出當投加適量的H2O2時,在偏酸性的廢水中Fenton反應十分明顯,COD的去除率有效提高;但當H2O2投加過量時,一部分H2O2可能直接將Fe2+氧化成Fe3+,COD的去除率增加放緩;而當H2O2投加過少時,反應不完全,且會產生沉淀。從實驗結果看,以10 mL/L的H2O2投加量為宜。
4.2 反應時間對處理效果的影響
按微電解正交和單因素實驗的結果,取最優條件下微電解反應后的出水100 mL于燒杯中,H2O2投加量為10 mL/L,反應時間設置為0.25~2.50 h,步長取0.25 h,反應完成后測定其COD去除率,結果見圖 5。
圖 5 反應時間對耦合反應COD去除率的影響
由圖 5可以看出,在反應開始的前15 min時,COD去除率就達到80.72%,隨著反應時間的延長COD去除率逐漸增加到87.61%。由于此類易揮發分解的氧化劑氧化作用主要在最初的時間段發揮作用,因此在實際工業廢水處理中,為減小處理裝置的占地,可將反應時間控制在0.5 h左右,實驗中此時COD去除率達到85.63%。
5 微電解-Fenton耦合動態實驗結果
在靜態實驗研究基礎上,考慮工業廢水處理的實際需要,設計了一連續處理工藝(圖 1)進行動態實驗,實驗條件為前述的靜態耦合的最佳工藝條件,調節流速保證廢水在反應柱內的停留時間約為 2.0 h,液固比在12∶5,廢水初始pH在2左右先進微電解,微電解出水進入Fenton反應器中,反應時間約0.5 h后進入沉淀池(加入NaOH液調節pH到8~9),沉淀3~4 h后上清液溢流出水。實驗裝置連續運行156 h,其COD處理結果見圖 6。
圖 6 動態連續實驗COD的去除率
實驗結果可看出:在連續反應前72 h中,COD去除率始終維持在80%以上,這與靜態實驗的數據較為吻合,反應72 h以后,去除率有所下降。這是由于在連續反應時,微電解填料中的鐵始終處于消耗狀態,部分的殘渣會沉積在填料表面,使微電解反應速率下降;同時進入Fenton反應器的Fe2+會減少,削弱了Fenton反應,通過及時補充或更新微電解填料可以彌補這一不足。在對耦合動態反應后廢水的COD檢測表明,此時的COD僅有399.28~401.64 mg/L,且其可生化性有效提高,滿足后續的生物處理要求。
6 結論
對微電解-Fenton耦合機理進行闡述,提出了微電解-Fenton耦合處理DDNP廢水的工藝及條件。對微電解法、Fenton法、微電解-Fenton耦合靜態、動態處理廢水的情況進行了分析,得出以下結論:具體參見http://www.bnynw.com更多相關技術文檔。
(1)微電解實驗結果表明,影響微電解處理 DDNP廢水效果的因子主次順序為:pH、液固比、反應時間和溫度。實驗條件下的最佳工藝條件為:常溫,廢水初始pH=2,液固比為12∶5,反應時間為 2.0 h,此時COD去除率達到60.28%。
(2)Fenton氧化法實驗結果表明,影響Fenton氧化處理DDNP廢水效果的因子主次順序為:H2O2 投加量、反應時間、初始pH、FeSO4 投加量。實驗條件下的最佳工藝條件為:常溫,廢水初始pH=5時,H2O2投加量為30 mL/L,0.3 mol/L的FeSO4溶液投加量為30 mL/L,最佳工藝條件下廢水COD去除率達到80.54%。
(3)采用微電解-Fenton 耦合法靜態處理表明,微電解初始反應廢水pH=2,液固比為12∶5,H2O2 投加量為10 mL/L,反應時間為0.5 h,COD去除率達到85.63%。
(4)采用微電解-Fenton 耦合法動態處理具有可行性。結果表明,進水pH=2,水力停留時間為2.0 h,在連續運行的前72 h內,COD去除率在80%以上,此時DDNP廢水的COD為399.28~401.64 mg/L,具有較高的可生化性。對比微電解和Fenton單獨處理DDNP廢水的實驗,微電解-Fenton耦合處理不僅降低了成本,而且有效改善廢水的可生化性,為后續處理創造了條件。